化学势和溶液体系的平衡计算
环顾周围世界,我们就会明了组成不变的相在自然界里是极少见的。地球化学的研究对象,如大气、海洋、地表淡水、岩浆和绝大部分造岩矿物的组成都是可变的,并且有的变化范围很大。在地球化学热力学处理中,它们都可以视为溶液。当一种或一种以上的物质溶解在另外一种物质之中,而形成均匀的一相,即为溶液,溶液可以表现为气态、液态和固态。
在地球化学中,大气和火山喷发气体就是气态溶液的例子。液态溶液主要表现为三类,一类是低温低压条件下的水溶液,如海洋水和大陆地表水;二是高温高压条件下的热水溶液即热液系统,如成矿热液和变质热液;三是高温高压条件下的硅酸盐熔体,即岩浆系统,岩浆体系的热力学问题是很复杂的。根据溶质—溶剂和溶质—溶质之间的相互作用,溶液可以分为电解质溶液和非电解质溶液。许多常见的造岩矿物族,如长石、辉石、闪石、云母和粘土矿物等都是固体溶液的例子。
关于高盐度地表水、热水溶液、岩浆和固溶体热力学研究都是现代地球化学热力学领域中的热门话题,近20年来溶液体系的热力学研究取得了极大进展,大大促进了地球化学热力学的发展。如果将简单体系的热力学计算,比作为应用地球化学热力学方法处理地质地球化学问题的定性分析,那么溶液体系的热力学计算则是定量分析了,它更加逼近于实际,更加真实。限于本课程的性质,对溶液体系热力学仅作最基本的介绍,应用溶液体系热力学原理研究卤水、热水溶液、岩浆和矿物固体溶液的具体展开在本章中不再介绍了。概而言之,溶液体系热力学的关键在于:
1)确定溶液体系的自由能与其组成变化的关系,即确定化学势函数的变化特征;
2)确定溶液中各组份的浓度与逸度和活度之间的关系,即确定溶液中各组份的逸度系数和活度系数。溶液体系的组成变化采用各组份的摩尔分数或摩尔数表示。一个体系的自由能除了与强度变量温度T和压力P有关外,还与各组份的数量,即溶液体系的成分有关。因此对溶液体系,G=G(T,p,n1,n2,…)。其全微分为,

在地球化学中,大气和火山喷发气体就是气态溶液的例子。液态溶液主要表现为三类,一类是低温低压条件下的水溶液,如海洋水和大陆地表水;二是高温高压条件下的热水溶液即热液系统,如成矿热液和变质热液;三是高温高压条件下的硅酸盐熔体,即岩浆系统,岩浆体系的热力学问题是很复杂的。根据溶质—溶剂和溶质—溶质之间的相互作用,溶液可以分为电解质溶液和非电解质溶液。许多常见的造岩矿物族,如长石、辉石、闪石、云母和粘土矿物等都是固体溶液的例子。
关于高盐度地表水、热水溶液、岩浆和固溶体热力学研究都是现代地球化学热力学领域中的热门话题,近20年来溶液体系的热力学研究取得了极大进展,大大促进了地球化学热力学的发展。如果将简单体系的热力学计算,比作为应用地球化学热力学方法处理地质地球化学问题的定性分析,那么溶液体系的热力学计算则是定量分析了,它更加逼近于实际,更加真实。限于本课程的性质,对溶液体系热力学仅作最基本的介绍,应用溶液体系热力学原理研究卤水、热水溶液、岩浆和矿物固体溶液的具体展开在本章中不再介绍了。概而言之,溶液体系热力学的关键在于:
1)确定溶液体系的自由能与其组成变化的关系,即确定化学势函数的变化特征;
2)确定溶液中各组份的浓度与逸度和活度之间的关系,即确定溶液中各组份的逸度系数和活度系数。溶液体系的组成变化采用各组份的摩尔分数或摩尔数表示。一个体系的自由能除了与强度变量温度T和压力P有关外,还与各组份的数量,即溶液体系的成分有关。因此对溶液体系,G=G(T,p,n1,n2,…)。其全微分为,

教育新鲜事
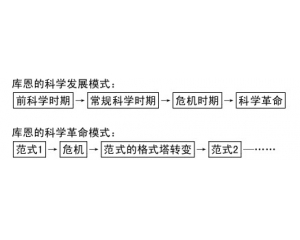 “复式”化学革命模式
“复式”化学革命模式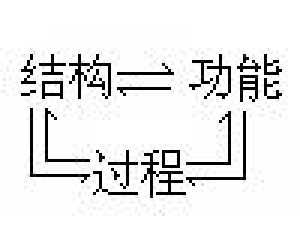 结构、过程与功能的相互
结构、过程与功能的相互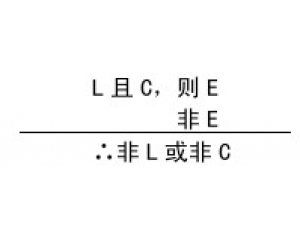 检验的复杂性
检验的复杂性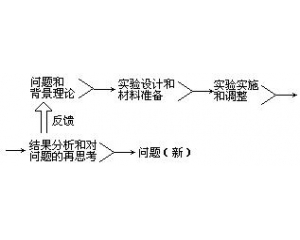 实验操作的程序
实验操作的程序