化学:2009年命题预测及名师指导(6)
(4)了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
【导读】物质的结构决定物质的性质,要更好地掌握物质的性质,必须熟练掌握物质的结构。
【试题举例】(2008·广东)元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是( )
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ2
【答案】B
【解析】本题较难,考查的是元素周期律及元素周期表的知识。关键是对周期表熟悉,由题干可推出XYZ3为MgCO3或NaNO3,再对比选项可知B正确。
7.元素周期律和周期表
(1)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。
(2)以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
【导读】要掌握元素周期律的实质,弄清元素性质随着核外电子排布的周期性变化规律,最外层电子数目多少及原子半径大小对元素化学性质的影响,同周期元素从左到右、同主族元素从上到下化学性质的递变规律。
【试题举例】(2008·全国Ⅰ)下列化合物,按其晶体的熔点由高到低排列正确的是( )
A.SiO2 CsCl CBr4 CF4
B.SiO2 CsCl CF4 CBr4
C.CsCl SiO2 CBr4 CF4
D.CF4 CBr4 CsCl SiO2
【答案】A
【解析】物质的熔、沸点属于物质的物理性质,与晶体类型有关,一般地,熔沸点由高到低的顺序为原子晶体>离子晶体>分子晶体,本题考查了四种晶体类型判断及其熔点高低的决定因素。对于离子晶体、原子晶体、金属晶体来讲,此三种晶体的熔点与构成它们的微粒间的半径大小正反比,即微粒间的半径越小其熔点就越高;而对于结构相似的分子晶体来讲,其熔点高低与其相对分子质量成正比;A中SiO2是原子晶体,熔点很高,CsCl为离子晶体,熔点较高,CBr4与CF4为结构相似的分子晶体,显然CBr4的熔点高于CF4,故以上四种晶体的熔点由高到低的正确顺序为SiO2>CsCl>CBr4>CF4。
8.化学反应速率、化学平衡
(1)了解化学反应速率的概念及反应速率的表示方法。理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响。
(2)了解化学反应的可逆性。理解化学平衡的含义及其与反应速率之间的联系。
(3)理解勒夏特列原理的含义。理解浓度、温度、压强等条件对化学平衡移动的影响。
(4)以合成氨工业生产为例,用化学反应速率和化学平衡的观点理解工业生产的条件。
【导读】影响化学反应速率的因素,化学平衡的标志,影响化学平衡的因素,是这部分的重点内容。
【试题举例】(2008·全国Ⅰ)已知:4NH3(g)+5O2(g)===4NO(g)+6H2O(g),ΔH=-1 025 kJ/mol,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
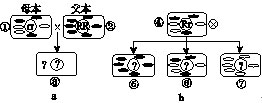
【答案】C
【解析】此题把影响化学平衡移动的因素与化学平衡移动的图象较紧密地结合在一起进行考查,属于中档题。影响化学平衡移动的因素通常有浓度、温度、压强。此反应是一个正方向气体分子数增加的放热反应,结合图象信息可知,A中升温可加快正、逆反应速率,缩短达到平衡的时间,且温度越高,达到平衡的时间越短,但平衡会往吸热的逆方向发生移动,导致NO的含量减少,A项图象所反映的信息是正确的,而C项图象所反映的信息是错误的;B中增压也可加快正、逆反应速率,缩短达到平衡的时间,且压强越高,达到平衡的时间越短,平衡会往气体分子数减少的逆方向发生移动,导致NO的含量减少,显然B项图象所反映的信息是正确的;D中使用催化剂可同等加快正、逆反应速率,缩短达到平衡的时间,但平衡不会发生移动,图象所反映的信息显然是正确的。
相关文章
- 中学化学学习方法处理好作业
- 中学化学学习
- 掌握做题步骤,过好“三关”
- 如何学习中学化学
- 化学研究的确实是化学键的断裂与重组
- 元素化学这一块要不要做很多题目?
- 有机化学务必在第一时间找出原因
- 化学相关知识
- 中学化学指南
- 中学化学教学
- 高中化学离子方程式,离子共存,离子效验
- 高中化学基本知识点高一化学方法与资料
- 高中化学学习方法帖,元素化学
- 高中化学学习方法总结
- 高二化学||化学反应速率与化学平衡类试题的解题方法与技巧
- 3大技巧让你高考化学选择题正确率飙升!
- 高考化学必备元素周期表6大知识点及相应29个误区判断
- 高考化学高分必备的二十种物质鉴别方法,收藏!
- 高中化学实验现象80例,学生最好人手一份
- 高中化学有机高考重点知识汇总,考前必须看一遍!
推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,