高二化学||化学反应速率与化学平衡类试题的解题方法与技巧
化学反应速率及其影响因素
1.定义:用来衡量化学反应进行快慢的物理量,符号用υ。
2.表示方法:通常用单位时间内反应浓度的减少或生成物浓度的增加来表示。
3.表达式:υ=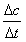 (υ:平均速率,Δc:浓度变化量,Δt:时间变化量)。
(υ:平均速率,Δc:浓度变化量,Δt:时间变化量)。
4.单位:mol/(L·s)或mol/(L·min)或mol·L-1·min-1或mol·L-1·s-1
5.规律:同一反应在同一时间内,用不同物质来表示的反应速率可能不同,但反应速率的数值之比等于这些物质在化学方程式中的化学计量数之比。

可逆反应达到平衡状态有两个核心的判断依据:①正反应速率和逆反应速率相等。②反应混合物中各组成成分的百分含量保持不变。只要抓住这两个特征就可确定反应是否达到平衡状态,对于随反应的发生而发生变化的物理量如果不变了,即说明可逆反应达到了平衡状态。判断化学反应是否达到平衡状态,关键是看给定的条件能否推出参与反应的任一物质的物质的量不再发生变化。
化学平衡移动
(1)概念:可逆反应达到平衡状态以后,若反应条件(如温度、浓度、压强等)发生了变化,平衡混合物中各组分的浓度也会随之改变,从而在一段时间后达到新的平衡状态。这种由原平衡状态向新平衡状态的变化过程,叫做化学平衡的移动。
(2)过程:
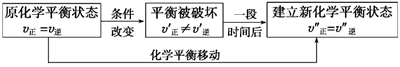
(3)平衡移动方向与化学反应速率的关系:v正>v逆,平衡向正反应方向移动;v正=v逆,平衡不移动;v正<v逆,平衡向逆反应方向移动。
外界条件对化学平衡的影响:
可以用一句话概括,即勒夏特列原理(平衡移动原理):如果改变影响平衡的条件之一(如温度,压强,浓度),平衡向着能够减弱这种改变的方向移动。

(1)由于压强的变化对非气态物质的浓度基本无影响,因此,当反应混合物中不存在气态物质时,压强的变化不能使无气态物质存在的化学平衡发生移动。
(2)气体减压或增压与溶液稀释或浓缩的化学平衡移动规律相似
(3)对于反应前后气体分子数无变化的反应,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
(4)同等程度地改变反应混合物中各物质的浓度,应视为压强对平衡的影响。
(5)“惰性气体”对化学平衡的影响
①恒温、恒容条件:原平衡体系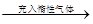 体系总压强增大→体系中各组分的浓度不变→平衡不移动。
体系总压强增大→体系中各组分的浓度不变→平衡不移动。
②恒温、恒压条件:原平衡体系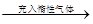 容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
容器容积增大,各反应气体的分压减小→体系中各组分的浓度同倍数减小(等效于减压),平衡向气体体积增大的方向移动。
(6)催化剂对化学平衡的影响:由于使用催化剂对正反应速率和逆反应速率影响的程度是等同的,所以平衡不移动。但是使用催化剂可以影响可逆反应达到平衡所需的时间。

(1)不要把v正增大与化学平衡向正反应方向移动等同,只有v正>v逆时,才使化学平衡向正反应方向移动。
(2)不要把化学平衡向正反应方向移动与反应物转化率的提高等同,当反应物总量不变时,化学平衡向正反应方向移动,反应物的转化率提高;当增大一种反应物的浓度,使化学平衡向正反应方向移动时,会使另一种反应物的转化率提高,而本身的转化率降低。
(3)对原理中“减弱这种改变”的正确理解是升高温度时,化学平衡向吸热反应的方向移动;增加反应物,化学平衡向反应物减少的方向移动;增大压强时,化学平衡向气体体积缩小的方向移动。
(4)结果只是减弱了外界条件的变化,而不能完全抵消外界条件的变化。达到新化学平衡时,此物理量更靠近改变的方向。如增大反应物A的浓度,化学平衡右移,但达到新化学平衡时,A的浓度比原化学平衡时大;同理,若改变的条件是温度或压强等,其变化也相似。
(5)平衡移动原理不仅能用于判断化学平衡的移动方向,也能用于判断溶解平衡等其他平衡移动的方向,可以说,平衡移动原理对所有的动态平衡都适用,如电离平衡、水解平衡等。
(6)平衡移动原理能用来判断平衡移动的方向,但不能用来判断建立新平衡所需要的时间。
化学平衡常数
(1)概念:在一定温度下,一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数比值,用符号K表示。
(2)表达式:对于一般的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),在一定温度下达到平衡时:K=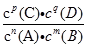 。
。

(1)表达式中各物质的浓度是平衡时的浓度,不是起始浓度也不是物质的量。
(2)对于一个具体的可逆反应,平衡常数K只与温度(T)有关,与反应物或生成物的浓度无关。(3)正逆反应的化学平衡常数不一样,互为倒数关系。
(4)反应物或生成物中有固体或纯液体存在时,由于其浓度看视为常数,是固定不变的,不能代入平衡常数表达式中。
(5)化学平衡常数是指某一具体反应的平衡常数。若化学方程式中各物质的化学计量数等倍扩大或缩小,尽管是同一反应,平衡常数也会改变。
(6)稀溶液中进行的反应,如有水参加,水的浓度不必写在平衡常数表达式中。

(1)化学平衡常数值的大小是可逆反应进行程度的标志。K值越大,说明平衡时生成物的浓度越大,反应物的浓度越小,它的正向反应进行的程度越大,即该反应进行得越完全,反应物转化率越高。反之,则相反。一般地,K>105时,该反应就进行得基本完全了。可以说,化学平衡常数是在一定温度下一个反应本身固有的内在性质的定量体现。
(2)可以利用K值做标准,判断正在进行的可逆反应是否平衡及不平衡时向何方进行建立平衡。(Q:浓度积)对于可逆反应aA(g)+bB(g)?cC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系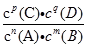 =Qc,则Qc<K反应向正反应方向进行,v正>v逆;Qc=K反应处于化学平衡状态,v正=v逆;Qc>K反应向逆反应方向进行,v正<v逆。
=Qc,则Qc<K反应向正反应方向进行,v正>v逆;Qc=K反应处于化学平衡状态,v正=v逆;Qc>K反应向逆反应方向进行,v正<v逆。
(3)利用K值可判断反应的热效应
若温度升高,K值增大,则正反应为吸热反应
若温度升高,K值减小,则正反应为放热反应
化学平衡及其移动图像中的数形思想
化学平衡图像题的解题步骤:有关化学平衡、化学反应速率的图表题一直是高考关注的热点,在审题时,一般采用“看特点,识图像,想原理,巧整合”四步法。
推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,