自由能和简单体系的平衡计算
自由能在地球化学热力学文献中常称为吉布斯(Gibbs)自由能,它是以温度T和压力p为变量的特征函数。地球化学正是研究在地球演化历史中以T,p为条件的各种天然化学作用,较之其他态函数,自由能G在地球化学热力学中居关键位置。它是在T,p条件下体系的平衡状态和自发过程进行方向的判据。和化学热力学一样,地球化学热力学对于各种地球化学反应(包括相变)总是要回答两个重要问题:
1)在什么条件下产物和反应物达到化学平衡?
2)若产物和反应物未达到平衡,那么化学反应将向何方向进行?原则上,热力学第二定律为上述两个问题提供了答案。
由熵判据(dS)U,V≥0可知,对于等内能和等容体系(即为孤立体系)而言,当(dS)U,V=0即体系达到平衡态,而(dS)U,V>0 即为体系内反应的进行方向。但是熵判据不能直接用于等温等压条件下判别体系的平衡状态和反应进行的方向。对此采用等温等压条件下的自由能判据更加适宜。dG=dU-TdS-SdT+pdV+Vdp在等温(dT=0)、等压(dp=0)条件下,仅考虑pV功时,则上式简化为:

对于成分可变的体系(或统称为溶液体系),除了温度、压力因素外,还必须了解成分变化对自由能的影响,以确定体系的平衡状态和过程进行的方向。下面先考查温度、压力对自由能的影响。已知 dG=-SdT+Vdp,对于一个化学反应而言,则
1)在什么条件下产物和反应物达到化学平衡?
2)若产物和反应物未达到平衡,那么化学反应将向何方向进行?原则上,热力学第二定律为上述两个问题提供了答案。
由熵判据(dS)U,V≥0可知,对于等内能和等容体系(即为孤立体系)而言,当(dS)U,V=0即体系达到平衡态,而(dS)U,V>0 即为体系内反应的进行方向。但是熵判据不能直接用于等温等压条件下判别体系的平衡状态和反应进行的方向。对此采用等温等压条件下的自由能判据更加适宜。dG=dU-TdS-SdT+pdV+Vdp在等温(dT=0)、等压(dp=0)条件下,仅考虑pV功时,则上式简化为:

对于成分可变的体系(或统称为溶液体系),除了温度、压力因素外,还必须了解成分变化对自由能的影响,以确定体系的平衡状态和过程进行的方向。下面先考查温度、压力对自由能的影响。已知 dG=-SdT+Vdp,对于一个化学反应而言,则
教育新鲜事
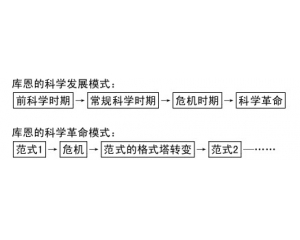 “复式”化学革命模式
“复式”化学革命模式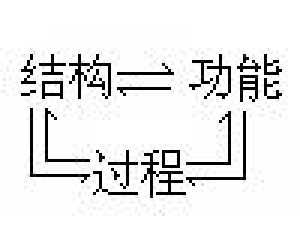 结构、过程与功能的相互
结构、过程与功能的相互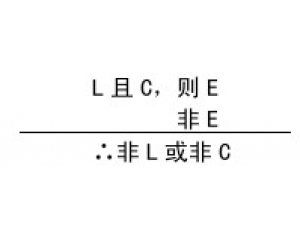 检验的复杂性
检验的复杂性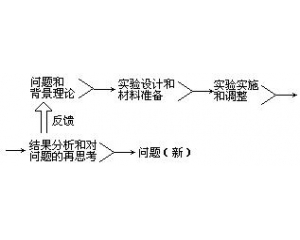 实验操作的程序
实验操作的程序