铁的化合物的性质
目的:认识铁的一些化合物的性质。
用品:试管、试管架、试管夹、量筒、滴管。氯化亚铁、氧化铁、四氧化三铁、氢氧化钠、硫酸亚铁、铁丝、三氯化铁、硫酸、氯化亚锡、过氧化氢。
原理:铁有亚铁化合物和铁化合物两种,铁化合物比亚铁化合物稳定。制备Fe(OH)2时必须去氧才能得到白色沉淀。一般说来,Fe2+的水合离子呈淡绿色,Fe3+水合离子呈淡紫色。三价铁盐水溶液显黄色是由 Fe3+水解作用所引起的。
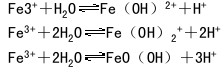
操作:1.铁的氧化物
(1)铁的三种氧化物:展示氧化亚铁、氧化铁和四氧化三铁。氧化亚铁在自然界中不存在,展示的氧化亚铁可以由加热分解草酸亚铁制得。
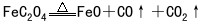
(2)铁的氧化物跟酸碱的反应:取两支试管,各盛2摩/升HCl溶液5毫升,分别加入少量氧化亚铁和氧化铁。微微加热,见两试管内的铁的氧化物都能溶解,前者生成淡绿色的氯化亚铁溶液,后者生成黄色的氯化铁溶液。另取两支试管,各盛2摩/升NaOH溶液5毫升,分别加入少量氧化亚铁和氧化铁,同样微微加热,但两支试管里的固体物都不溶解。这就说明氧化亚铁和氧化铁都是碱性氧化物。天然产的四氧化三铁矿石既不溶于酸,也不溶于碱。
2.铁的氢氧化物在大试管里盛蒸馏水 5 毫升,煮沸以去除其中溶解的氧气。加入 1~2滴1摩/升H2SO4酸化,再加入少量洗净的硫酸亚铁绿色晶体(先把外层黄色物质的三价铁的碱式盐刮掉,再用少量不含氧蒸馏水冲洗1~2次),但不要摇动,以防混入空气。为了加速溶解,可以微微加热。为了防止配成的硫酸亚铁溶液里含有少量Fe3+,可加入光亮的铁丝一小团。在另一支试管里加入2摩/升NaOH溶液5毫升,煮沸去氧后,加入硫酸亚铁溶液里,可得白色的氢氧化亚铁絮状沉淀。往盛氢氧化亚铁沉淀的试管里加入硫酸3毫升,轻轻摇和,氢氧化亚铁沉淀即溶解。在一支试管内盛三氯化铁溶液5毫升,加入等量的氢氧化钠溶液,摇匀,即得红褐色凝胶状氢氧化铁沉淀。把沉淀物连同液体分成两管,往一管内加入3摩/升H2SO43毫升,振荡,沉淀即溶解。把另一管内的液体煮沸,使氢氧化铁沉降,倾去上层液体后继续加热,氢氧化铁即失水而生成红色的氧化铁。
3.铁化合物和亚铁化合物间的相互转变 在试管里盛2毫升1摩/升FeCl3溶液,加入2毫升2摩/升盐酸酸化后,逐滴加入氯化亚锡溶液,黄色溶液逐渐变成绿色。这个实验也可以在酸化了的 FeCl3溶液中加入还原铁粉或新的铁钉使Fe3+转化为Fe2+。在另一支试管里盛2毫升1摩/升新制备的FeSO4溶液,加入4毫升1摩/升H2SO4酸化,逐滴加入3%的过氧化氢或新制备的氯水,可以使溶液的颜色从绿变黄,将其中的Fe2+转化成Fe3+。其它实验方法:
1.用还原铁粉制备氢氧化亚铁 在一支大试管里盛还原铁粉少许,加入1摩/升H2SO4溶液①5毫升,微微加热以加快反应发生。1~2分钟后,溶液里已有一定量的硫酸亚铁生成。用胶头滴管吸取2摩/升 NaOH溶液插入硫酸亚铁溶液的液面下,注入1~2滴,即有白色絮状氢氧化亚铁沉淀生成。这时因溶液下部的铁与稀硫酸仍在继续反应,有氢气上升,驱除液面上的空气,可以延缓氢氧化亚铁被氧化变色。
用品:试管、试管架、试管夹、量筒、滴管。氯化亚铁、氧化铁、四氧化三铁、氢氧化钠、硫酸亚铁、铁丝、三氯化铁、硫酸、氯化亚锡、过氧化氢。
原理:铁有亚铁化合物和铁化合物两种,铁化合物比亚铁化合物稳定。制备Fe(OH)2时必须去氧才能得到白色沉淀。一般说来,Fe2+的水合离子呈淡绿色,Fe3+水合离子呈淡紫色。三价铁盐水溶液显黄色是由 Fe3+水解作用所引起的。
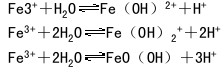
操作:1.铁的氧化物
(1)铁的三种氧化物:展示氧化亚铁、氧化铁和四氧化三铁。氧化亚铁在自然界中不存在,展示的氧化亚铁可以由加热分解草酸亚铁制得。
(2)铁的氧化物跟酸碱的反应:取两支试管,各盛2摩/升HCl溶液5毫升,分别加入少量氧化亚铁和氧化铁。微微加热,见两试管内的铁的氧化物都能溶解,前者生成淡绿色的氯化亚铁溶液,后者生成黄色的氯化铁溶液。另取两支试管,各盛2摩/升NaOH溶液5毫升,分别加入少量氧化亚铁和氧化铁,同样微微加热,但两支试管里的固体物都不溶解。这就说明氧化亚铁和氧化铁都是碱性氧化物。天然产的四氧化三铁矿石既不溶于酸,也不溶于碱。
2.铁的氢氧化物在大试管里盛蒸馏水 5 毫升,煮沸以去除其中溶解的氧气。加入 1~2滴1摩/升H2SO4酸化,再加入少量洗净的硫酸亚铁绿色晶体(先把外层黄色物质的三价铁的碱式盐刮掉,再用少量不含氧蒸馏水冲洗1~2次),但不要摇动,以防混入空气。为了加速溶解,可以微微加热。为了防止配成的硫酸亚铁溶液里含有少量Fe3+,可加入光亮的铁丝一小团。在另一支试管里加入2摩/升NaOH溶液5毫升,煮沸去氧后,加入硫酸亚铁溶液里,可得白色的氢氧化亚铁絮状沉淀。往盛氢氧化亚铁沉淀的试管里加入硫酸3毫升,轻轻摇和,氢氧化亚铁沉淀即溶解。在一支试管内盛三氯化铁溶液5毫升,加入等量的氢氧化钠溶液,摇匀,即得红褐色凝胶状氢氧化铁沉淀。把沉淀物连同液体分成两管,往一管内加入3摩/升H2SO43毫升,振荡,沉淀即溶解。把另一管内的液体煮沸,使氢氧化铁沉降,倾去上层液体后继续加热,氢氧化铁即失水而生成红色的氧化铁。
3.铁化合物和亚铁化合物间的相互转变 在试管里盛2毫升1摩/升FeCl3溶液,加入2毫升2摩/升盐酸酸化后,逐滴加入氯化亚锡溶液,黄色溶液逐渐变成绿色。这个实验也可以在酸化了的 FeCl3溶液中加入还原铁粉或新的铁钉使Fe3+转化为Fe2+。在另一支试管里盛2毫升1摩/升新制备的FeSO4溶液,加入4毫升1摩/升H2SO4酸化,逐滴加入3%的过氧化氢或新制备的氯水,可以使溶液的颜色从绿变黄,将其中的Fe2+转化成Fe3+。其它实验方法:
1.用还原铁粉制备氢氧化亚铁 在一支大试管里盛还原铁粉少许,加入1摩/升H2SO4溶液①5毫升,微微加热以加快反应发生。1~2分钟后,溶液里已有一定量的硫酸亚铁生成。用胶头滴管吸取2摩/升 NaOH溶液插入硫酸亚铁溶液的液面下,注入1~2滴,即有白色絮状氢氧化亚铁沉淀生成。这时因溶液下部的铁与稀硫酸仍在继续反应,有氢气上升,驱除液面上的空气,可以延缓氢氧化亚铁被氧化变色。
推荐内容
教育新鲜事
 土壤有效养分的化学速测
土壤有效养分的化学速测 利用阿斯匹林进行几种有
利用阿斯匹林进行几种有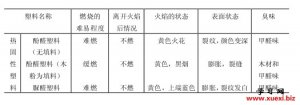 用燃烧法鉴别几种常用的
用燃烧法鉴别几种常用的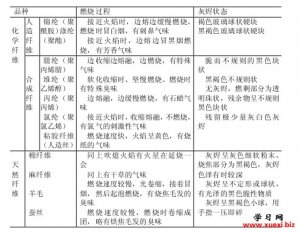 用燃烧法鉴别各种纤维
用燃烧法鉴别各种纤维