乙炔的制取和性质
目的:认识乙炔的实验室制法和性质。
用品:破试管、单孔塞、尖嘴管、广口瓶、导管、试管、玻璃丝、碎玻璃片、棉花、分液漏斗、橡皮管。碳化钙、饱和食盐水、溴水(1%)、高锰酸钾溶液(0.5%)、稀硫酸(1∶4)。
原理:乙炔在实验室里是用碳化钙(电石)和水反应制得的。CaC2+2H2O—→C2H2↑+Ca(OH)2乙炔分子中存在着叁键,能发生加成反应和氧化反应。准备和操作:
1.乙炔的制取 取一个底部有孔的破试管,孔上垫上一些疏松的玻璃丝或碎玻璃片,然后在上面放几小块碳化钙。试管口上配一个装有尖嘴玻管的单孔塞,在试管的上部靠近尖嘴管的下端塞一团疏松的玻璃丝或棉花,以防生成的泡沫溢入导管堵住管口。试管插在广口瓶的塞子内,瓶里盛约1/3容积的水。实验时,把试管往下移动插入水内,当碳化钙跟水接触时,乙炔气体就从导管口逸出,可以点燃,乙炔可用排水法收集。
2、乙炔的性质(1)加成反应:把乙炔通入盛有3毫升1%的溴水的试管里,可以看到溴水褪色。如果在充满乙炔的试管里注入一些溴水,塞上塞子,充分振荡,溴的褪色可以快一些。(2)氧化反应:在尖嘴管口点燃逸出的乙炔气体,能发出明亮而带有浓烟的火焰。在试管里盛水1/3体积,通入乙炔3~4分钟,加入0.5%高锰酸钾溶液(加几滴稀硫酸)2 毫升,混和后,溶液仍会有淡紫色。然后塞上塞子,剧烈振荡,紫色就会褪去,但比较缓慢:
3C2H2+10KMnO4+2H2O—→6CO2↑+10KOH+10MnO2↓这个实验也可以表明乙炔是微溶于水的。
注意事项:1.市售的碳化钙一般都不纯净,含有硫化钙、磷化钙、砷化钙等杂质,因此用它制取的乙炔气体里总含有硫化氢、磷化氢、砷化氢等气体。这些杂质气体对乙炔的性质实验虽无影响,但它们有特殊的臭味,而且有毒,所以制取乙炔时应防止生成的气体扩散到教室里。如果要获得较纯的乙炔,可以把生成的气体通过含有重铬酸钾的浓硫酸溶液的洗瓶以除去这些杂质。
2.碳化钙最好用蚕头大小的块状,如果颗粒太小甚至粉状,反应将异常猛烈,会产生大量泡沫。为了能使乙炔平稳而均匀地发生,可以用饱和食盐水代替水来制取。
3.乙炔加成反应中溴水浓度不能太大,因为乙炔跟溴水的加成反应要比乙烯慢得多①。其它实验方法:1.制取乙炔还可以利用两种装置。其中甲装置可控制产气速度,而且产气量也大。
用品:破试管、单孔塞、尖嘴管、广口瓶、导管、试管、玻璃丝、碎玻璃片、棉花、分液漏斗、橡皮管。碳化钙、饱和食盐水、溴水(1%)、高锰酸钾溶液(0.5%)、稀硫酸(1∶4)。
原理:乙炔在实验室里是用碳化钙(电石)和水反应制得的。CaC2+2H2O—→C2H2↑+Ca(OH)2乙炔分子中存在着叁键,能发生加成反应和氧化反应。准备和操作:
1.乙炔的制取 取一个底部有孔的破试管,孔上垫上一些疏松的玻璃丝或碎玻璃片,然后在上面放几小块碳化钙。试管口上配一个装有尖嘴玻管的单孔塞,在试管的上部靠近尖嘴管的下端塞一团疏松的玻璃丝或棉花,以防生成的泡沫溢入导管堵住管口。试管插在广口瓶的塞子内,瓶里盛约1/3容积的水。实验时,把试管往下移动插入水内,当碳化钙跟水接触时,乙炔气体就从导管口逸出,可以点燃,乙炔可用排水法收集。
2、乙炔的性质(1)加成反应:把乙炔通入盛有3毫升1%的溴水的试管里,可以看到溴水褪色。如果在充满乙炔的试管里注入一些溴水,塞上塞子,充分振荡,溴的褪色可以快一些。(2)氧化反应:在尖嘴管口点燃逸出的乙炔气体,能发出明亮而带有浓烟的火焰。在试管里盛水1/3体积,通入乙炔3~4分钟,加入0.5%高锰酸钾溶液(加几滴稀硫酸)2 毫升,混和后,溶液仍会有淡紫色。然后塞上塞子,剧烈振荡,紫色就会褪去,但比较缓慢:
3C2H2+10KMnO4+2H2O—→6CO2↑+10KOH+10MnO2↓这个实验也可以表明乙炔是微溶于水的。
注意事项:1.市售的碳化钙一般都不纯净,含有硫化钙、磷化钙、砷化钙等杂质,因此用它制取的乙炔气体里总含有硫化氢、磷化氢、砷化氢等气体。这些杂质气体对乙炔的性质实验虽无影响,但它们有特殊的臭味,而且有毒,所以制取乙炔时应防止生成的气体扩散到教室里。如果要获得较纯的乙炔,可以把生成的气体通过含有重铬酸钾的浓硫酸溶液的洗瓶以除去这些杂质。
2.碳化钙最好用蚕头大小的块状,如果颗粒太小甚至粉状,反应将异常猛烈,会产生大量泡沫。为了能使乙炔平稳而均匀地发生,可以用饱和食盐水代替水来制取。
3.乙炔加成反应中溴水浓度不能太大,因为乙炔跟溴水的加成反应要比乙烯慢得多①。其它实验方法:1.制取乙炔还可以利用两种装置。其中甲装置可控制产气速度,而且产气量也大。
推荐内容
教育新鲜事
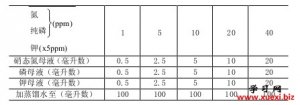 土壤有效养分的化学速测
土壤有效养分的化学速测 利用阿斯匹林进行几种有
利用阿斯匹林进行几种有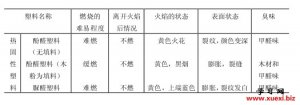 用燃烧法鉴别几种常用的
用燃烧法鉴别几种常用的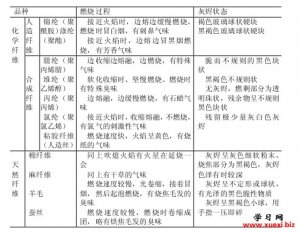 用燃烧法鉴别各种纤维
用燃烧法鉴别各种纤维