铝和氧化铝的性质
目的:掌握铝的重要化学性质以及氧化铝的两性。
用品:底端球形封口、另一端拉成尖嘴、约25厘米长的玻管、铁架台、铁夹、表面皿、O号砂纸、脱脂棉或滤纸、U形管、试管、带活塞的尖嘴玻管、漏斗、聚乙烯塑料。铝箔(16厘米2)、10%HgCl2溶液,着色乙醚、2摩/升硫酸、20%NaOH溶液、蒸馏水。
准备和操作:
1.铝在空气中氧化按图10—24进行装置。加热空玻璃球赶跑空气,再将尖嘴管插在乙醚(用品红着色)中,乙醚即上升进入管中,然后将玻管倒过来,乙醚就进入球内。没有乙醚,可用酒精代替。用砂纸将铝箔擦净,把铝箔包裹在盛乙醚的玻璃球上。在铝箔表面滴以HgCl2溶液(需用表面皿承接),当铝箔表面呈现灰色时,用脱脂棉或滤纸将HgCl2溶液吸干。铝箔表面有大量篷松的氧化铝生成,用玻棒将氧化铝刮入洁净的表面皿中。铝氧化时产生的热量,使球内乙醚蒸发,在玻管尖嘴处可点燃乙醚蒸气。
2.铝与水的作用进行装置。把聚乙烯塑料打上小孔,塞入U形管中作隔板用。管口配上带有活塞导气管(或夹子)的单孔塞,另一管口配上装有漏斗的橡皮塞。将上一个实验的铝箔取下,刮掉蓬松的氧化铝,立即投入装有隔板的 U形管中,塞上单孔塞。打开活塞,从漏斗中注入蒸馏水,使水充满U形管后,关闭活塞。可见铝箔表面有气泡逸出。气体上升,积留在反应管上方,液面下降,水被逐步压回到漏斗中。当收集到一定量的气体后,扭开活塞,用火柴点燃气体,可听到“扑”的一声,气体安静燃烧,并有不易觉察的火焰(用脱脂棉着火证明火焰的存在),证明该气体是氢气。
3.氧化铝的两性 将上述实验中刮取的氧化铝放入两个试管中,分别加入2摩/升H2SO4和20%NaOH溶液5毫升,振摇,氧化铝均立即溶解。
注意事项:若用氢氧化铝凝胶状沉淀来制备氧化铝,一是费时,二是加热温度不易控制,如高于 850℃,则生成α-Al2O3变体,既不溶于酸,也不溶于碱,只有在600℃以下的产物,才溶于酸和碱。
用品:底端球形封口、另一端拉成尖嘴、约25厘米长的玻管、铁架台、铁夹、表面皿、O号砂纸、脱脂棉或滤纸、U形管、试管、带活塞的尖嘴玻管、漏斗、聚乙烯塑料。铝箔(16厘米2)、10%HgCl2溶液,着色乙醚、2摩/升硫酸、20%NaOH溶液、蒸馏水。
准备和操作:
1.铝在空气中氧化按图10—24进行装置。加热空玻璃球赶跑空气,再将尖嘴管插在乙醚(用品红着色)中,乙醚即上升进入管中,然后将玻管倒过来,乙醚就进入球内。没有乙醚,可用酒精代替。用砂纸将铝箔擦净,把铝箔包裹在盛乙醚的玻璃球上。在铝箔表面滴以HgCl2溶液(需用表面皿承接),当铝箔表面呈现灰色时,用脱脂棉或滤纸将HgCl2溶液吸干。铝箔表面有大量篷松的氧化铝生成,用玻棒将氧化铝刮入洁净的表面皿中。铝氧化时产生的热量,使球内乙醚蒸发,在玻管尖嘴处可点燃乙醚蒸气。
2.铝与水的作用进行装置。把聚乙烯塑料打上小孔,塞入U形管中作隔板用。管口配上带有活塞导气管(或夹子)的单孔塞,另一管口配上装有漏斗的橡皮塞。将上一个实验的铝箔取下,刮掉蓬松的氧化铝,立即投入装有隔板的 U形管中,塞上单孔塞。打开活塞,从漏斗中注入蒸馏水,使水充满U形管后,关闭活塞。可见铝箔表面有气泡逸出。气体上升,积留在反应管上方,液面下降,水被逐步压回到漏斗中。当收集到一定量的气体后,扭开活塞,用火柴点燃气体,可听到“扑”的一声,气体安静燃烧,并有不易觉察的火焰(用脱脂棉着火证明火焰的存在),证明该气体是氢气。
3.氧化铝的两性 将上述实验中刮取的氧化铝放入两个试管中,分别加入2摩/升H2SO4和20%NaOH溶液5毫升,振摇,氧化铝均立即溶解。
注意事项:若用氢氧化铝凝胶状沉淀来制备氧化铝,一是费时,二是加热温度不易控制,如高于 850℃,则生成α-Al2O3变体,既不溶于酸,也不溶于碱,只有在600℃以下的产物,才溶于酸和碱。
推荐内容
教育新鲜事
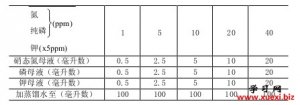 土壤有效养分的化学速测
土壤有效养分的化学速测 利用阿斯匹林进行几种有
利用阿斯匹林进行几种有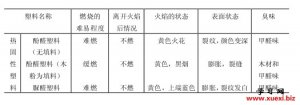 用燃烧法鉴别几种常用的
用燃烧法鉴别几种常用的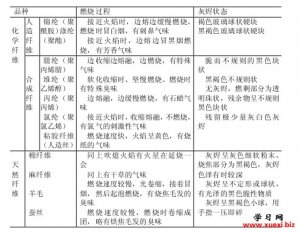 用燃烧法鉴别各种纤维
用燃烧法鉴别各种纤维