发现分子
1808 年, 法国的化学家盖—吕萨克, 在研究气体跟气体发生化学反应时, 得出了气体体积发生变化的规律.他发现参加反应的各种气体, 彼此的体积 (在一定压强和温度条件下) 成简单整数比.这是他通过许多实验事实证明而得出这一结论的.
在盖—吕萨克提出他的气体反应定律之前, 英国的化学家道尔顿刚刚宣布了原子论.但是, 如果根据道尔顿当时的原子论, 却无法解释盖—吕萨克的气体反应定律.因此, 当时他们这两种观点曾引起了一场争论, 直到建立了分子的概念, 弄清楚了原子跟分子的联系和区别之后, 这场争论才结束.他们两种观点发生争论的焦点在什么地万呢?
首先要明确的几个问题是:
第一, 波义耳和查理的定律, 适用於任何气体.这个事实可以设想为: 在同温同压下, 任何气体的体积相同时, 所包含有的微粒数相同.
第二, 盖—吕萨克的气体反应定律, 也同样适用於任何气体.这一事我们可以设想成: 参加反应的气体微粒数之间, 呈简单的整数比.但是以上的设想产生了这样一些矛盾.
首先按照道尔顿的说法, 氢气、氧气和气体中的微粒是简单原子, 即一个微粒只是一个原子, 并且道尔顿认为原子是不可分的.那末, 就解释不了2 体积氢气正好和1 体积氧气发生反应, 生成2 体积的水蒸汽这一事实;也就是说2 个氢微粒跟1 个氧微粒化合, 能生成2 个水微粒, 那么必然每个水微粒中只有半个氧微粒.道尔顿认为氧微粒 (即氧原子) 是不能分成两半的.然而事实上氧微粒 (即氧原子) 确是分开了.
其次, 道尔顿坚持氧微粒 (他以为是原子其实是分子) 是不可分的, 那就只能认为2 个体积氢气中的微粒数和1 体积氧气中的微粒数相等, 即2 个氢微粒和2 个氧微粒化合, 生成2 个水微粒.那么, 这种体积相等的气体中, 在同温同压条件下所含微粒数不一定相等的说法, 不仅毫无根据, 并且跟波义耳、查理两人的定律格格不入.
盖—吕萨克经过推理认为: 不同的气体在同样的体积 (指在同温、同压条件下) 中, 所含的原子 (不是前面所说的那种微粒) 数, 彼此应该有简单的整数比.现在来看, 这一推理是正确的, 而道尔顿认为微粒 (分子) 数可以是整数比, 甚至不成比例, 更不会一定相等的看法是错误的.可惜在当时那场争论中盖—吕萨克未能再进一步建立起分子的概念, 而道尔顿也一直认为水分子是一个氢原子和一个氧原子结合成的复杂原子.
因而道尔顿的原子论中, 是把原子和分子混为一谈了.道尔顿原子论的总体思想, 对当时化学的发展, 具有重大的积极意义, 然而其中也掺杂了一些机械的主观的东西.
1811 年, 意大利的物理学家阿佛加德罗, 参与了上述问题的讨论.他精心的研究了道尔顿和盖—吕萨克两人的全部资料, 经过了认真的思考后巧妙的构思出了一个周到的设想, 在道尔顿和盖—吕萨克两人的争论分歧之间, 架起了一座桥梁, 这便是分了, 和原子不同的真正的分子.
阿佛加德罗所设想的分子, 特别是单质的分子, 可以由不同数目的同种原子组成.他认为氢气、氧气等单质分子中, 各有两个原子.这样一来, 盖—吕萨克的气体反应定律, 就能得到很好的解释了.这可以用下列方程式来说明:
2 体积氢气+1 体积氧气=2 体积水蒸汽
2nH2+1nO2=2nH2O
2H2+O2=2H2O
用我们现有的化学知识, 便很容易理解上面的三层关系, 既能层层互相联系, 各自又很合理.如果第三个式子是
2H+O=2H2O 或2H+2O=2HO
那么都是说不通的.
阿佛加德罗提到的分子, 是从道尔顿的原子理论中分化出来的.这种分子的概念, 是阿佛加德罗根据宏观实验现象所做出的假想.是阿佛加德罗从困境中解救了道尔顿, 然而道尔顿却不相信阿佛加德罗的说法.作为原子论发起人的道尔顿, 坚持认为同种的原子必然互相排斥, 不能结合成分子, 否定H2、O2 的存在, 从根本上拒绝了阿佛加德罗的一片好心.
阿佛加德罗提出的分子假说, 根本就是对的, 但由於遭到别人的反对.自己却又提不出更有力的事实来作为旁证.加上当时化学学术界, 还没有统一的原子量, 也没有固定的化学反应式, 很多认识比较片面, 思想混乱.所有这些, 都使得阿佛加德罗的学说遭受冷遇竟达50 多年之久.直到1860 年, 在一次国际性的化学会议上, 人们还在为分子假说争论不休, 毫无结果而散会时, 阿佛加德罗的学生意大利物理学家康尼查罗, 散发了他的关於论证分子学说的小册子.
康尼查罗在小册子的文章中, 重新提到了他的老师的假说, 用充分的论据明确指出: `……近来化学领域所取得的进展, 已经证实阿佛加德罗、安培和杜马的假说, ……即等体积的气体中, 无论是单质或是化合物, 都含有相同数目的分子, 但它绝不是含有相同数目的原子.……阿佛加德罗和安培的学说必须充分加以利用.' (安培和杜马也曾有跟阿佛加德罗近似的设想) 康尼查罗的论文条理清楚, 呈述严谨, 他的要求和分析很快得到了化学界的赞许和承认.近代的原子——分子的统一理论, 终於在19 世纪的60 年代得以确立.
气体都是以分子状态存在的, 化合物的分子都是由几种不同的原子构成的.并且在同温同压下, 相同体积的气体所含原子数也不一定相同, 然而所含的分子数却是肯定相同的, 都是6.02×1023 个, 后人将这个数叫阿伏伽德罗常数.在原子和宏观物质之间由於有了分子这一概念的过渡, 许多化学反应便都很好解释了.这在化学史上是一大突破.所以恩格斯指出化学的新时代是从原子论开始的, `近代化学之父不是拉瓦锡, 而是道尔顿.'
教育新鲜事
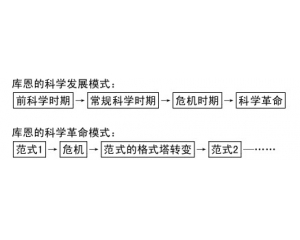 “复式”化学革命模式
“复式”化学革命模式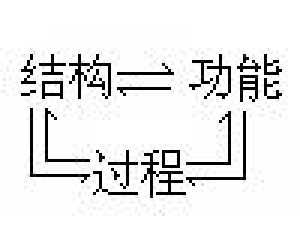 结构、过程与功能的相互
结构、过程与功能的相互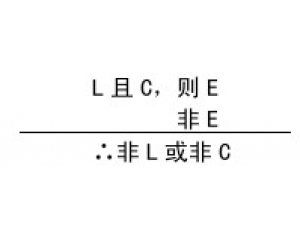 检验的复杂性
检验的复杂性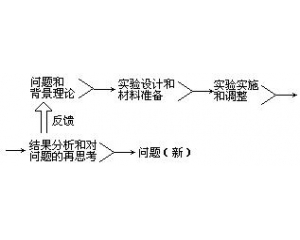 实验操作的程序
实验操作的程序