元素周期表
现在, 元素周期表早已为人们熟悉了, 化学和物理学教科书里, 各种手册里, 甚至连常用的小字典里都印着它.在这里我们先把元素周期表作一些简单的介绍.
大家一定很熟悉剧场和电影院的坐次表吧.那是一张按剧场坐位画出来的表.如果你拿到一张电影票, 只要看看那张表, 不用走进电影院, 就能知道自己坐在哪儿, 因为那张表上, 把每个号码的位置都画出来了.
周期表就是化学元素的`坐次表'.每个元素该坐在哪一行, 哪一列, 表上都写得清清楚楚.
下面的这张表就是现在常见的一种元素周期表.为了让初学的人容易了解, 我们简化了它的内容.
初见到这张表的人常常会产生这样的问题: 为什么要把这张表叫做元素周期表呢?
在我们周围的世界中, 存在着形形色色、各不相同的许多种类的物体.
这多种多样的物体, 都是由为数不多的一些元素的原子所构成.到目前为止, 人们已经发现的元素 (包括人造元素) 一共只有107 种.
由同一种元素的原子组成的物质, 叫做单质, 例如, 金、银就都是单质, 因为它们分别由同一种金元素和同一种银元素的原子所组成.氧气、氢气也都是单质, 它们分别由氧元素和氢元素的原子组成为氧气和氢气的分子.由不同元素的原子互相化合而成的物质, 叫做化合物.例如, 我们每天都离不开的食盐和水, 就都是化合物, 食盐是由钠元素的原子同氯元素的原子互相化合而成的;水是由氢元素的原子同氧元素的原子互相化合而成的.把这100多种化学元素, 按照它们的原子核所带的电荷的多少 (即原子序数) , 依次排列起来, 这些元素以及由它们所组成的单质和化合物的性质, 就表现出有规则的变化, 并且, 经过一定的间隔, 就重复出现这种有规则的变化.例如, 从第3 号元素锂到第10 号元素氖, 这8 个元素的单质, 由典型的金属锂, 经过金属性较弱的铍, 过渡到非金属硼和碳, 再经过非金属性越来越强的氮和氧, 到典型的非金属氟, 然后经过惰性气体氖便又出现了典型金属钠.从第11 号元素钠, 到第18 号元素氩, 又重复出现了上面的这种有规则的变化, 依次出现典型的金属、金属性较弱的元素、非金属、非金属性较强的元素、典型的非金属, 最后出现另一个惰性气体氩.类似这种周而复始的变化, 共达7 次之多.这种类似性质的元素之间的间隔, 便叫做周期.
因此, 人们把这种元素以及由它们所组成的单质和化合物的性质, 随着原子序数的增大而周期地改变的规律, 叫做元素周期律.
根据元素周期律, 人们把107 种元素按周期和族类列表排出, 以便於学习和应用.这种表就叫做元素周期表.
在周期表里, 我们把横排叫做周期.现在周期表里, 共有7 个横排, 就是有7 个周期.纵行叫做族, 就是家族的意思;族里面还有主族和副族之分.现在的周期表里共有8 个主族, 它们是第1 到7 主族和零族.还有8 个副族, 它们是第1 到第7 副族以及第8 族.表的左侧标出的阿拉伯数字, 代表周期的次序;表的上方的罗马数字代表族的次序;罗马数字右边的字母A 代表主族, B 代表副族.
以前混乱的、互相间好像毫无联系的各种元素, 在周期表里都整整齐齐地排好了队.它们排列得就像少先队员们排队时那样整齐, 横看横成列, 竖看竖是行.不过, 少先队员是按个子高矮, 而元素排队是按它们的核电荷数的多少 (门捷列夫当时是按原子量的大小) 来排列的.
由於元素周期表是根据元素周期律排列出来的, 因而在每一个横排也就是同一个周期里的元素的性质, 从左到右呈现出有现则的变化;每一竖行也就是同一族里的元素, 都具有相似的性质, 并且这种性质依照从上到下的次序也呈现出逐步增强或者减弱的趋势.
通常人们都用元素的金属性和非金属性来表示这些规律.
什么是元素的金属性和非金属性呢?
一种物质如果像金、银那样闪闪发亮, 人们就说它有金属光泽.金属光泽就是一种金属性.通常所说的金属性还有传热、导电等等.不过这类性质都不牵涉到物质成分的改变.所以它们都属於物质的物理性质.物质的金属性的更重要的表现, 还在於它们的化学性质, 也就是物质在发生化学反应的时候所表现出来的性质.一个典型的金属能和氧、和非金属、和酸等物质起化学反应.一般衡量一个元素的金属性是强还是弱, 是看它的最高氧化物和水起反应所生成的化合物碱性是强还是弱.一个元素的最高氧化物的水化物如果呈碱性, 那么, 这个元素就呈现金属性, 碱性越强, 元素的金属性也越强.
比如说钠元素吧, 它除了具有金属光泽, 能传热导电, 并能和氧、非金属、酸等物质起反应外, 它的氧化物也就是氧化钠, 能和水反应生成氢氧化钠.氢氧化钠是一个很强的碱 (俗称火碱) , 因此, 钠就被认为是一个金属性很强的元素.
同样的道理, 一个元素的非金属性, 也是用类似的方法去判断的.不过, 标准正好和前面说的相反, 是看它的最高氧化物水化物的酸性如何了.一个元素氧化物的水化物酸性越强, 就说明它的非金属性越强.
例如硫元素, 它的最高氧化物 (三氧化硫) 的水化物是硫酸.硫酸是著名的三大强酸之一, 因此, 硫是一个具有较强的非金属性的元素.
在元素周期表里, 元素的金属性和非金属性表现出明显的有规则的变化: 在同一周期里, 元素的金属性随着原子序数的增加而减弱, 元素的非金属性随着原子序数的增加而加强.
比如, 拿第2 周期来说:
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA O
钠 镁 铝 硅 磷 硫 氯 氩
钠元素的氧化物的水化物——氢氧化钠, 是一个著名的强碱.
镁元素的氧化物的水化物——氢氧化镁, 是一个中等强度的碱, 比氢氧化钠要弱得多.
铝元素的氧化物的水化物——氢氧化铝则是一个典型的两性化合物, 它既同酸发生反应表现出碱性, 又能同强碱发生反应表现出酸性.
硅元素的氧化物的水化物——硅酸, 是一个极弱酸.
磷元素的最高氧化物的水化物——磷酸, 是一个中强酸, 比硅酸的酸性要强得多.
硫元素的最高氧化物的水化物——硫酸, 已经是一个著名的强酸了.
氯元素的最高氧化物的水化物——高氯酸, 是无机酸中最强的酸.
同一个主族里的元素, 具有相似的性质.比如, 第1 主族的元素, 除氢元素外, 都是余属性很强的元素, 它们的氧化物的水化物都是强碱, 所以, 人们又把它们叫做碱金属.第7 主族的元素, 都是非金属性很强的元素, 它们的最高氧化物的水化物都是强酸.
在同一主族里面, 随着原子序数的递增, 元素的金属性增强, 非金属性减弱.比如, 在第3 主族里, 最上边的元素硼的非金属性较强, 它的氧化物水化物是一个弱酸, 就是平常眼科医生给病人洗眼用的硼酸.硼下边的元素铝, 已经说过是一个两性元素, 既具有明显的金属性, 也有一定的非金属性.而这一家族的最下边的成员铊, 就具有较强的金属性, 它的最高氧化物的水化物已经是一个典型的碱, 而不具有酸性了.
在元素周期表里, 元素的化合价, 也就是一种元素的原了, 能和他种元素的原子相结合的数目, 也表现出有规则的变化.
不只是金属性、非全属性和化合价, 元素的几乎所有性质, 在同一周期和同一族里, 都是按顺序逐渐变化的.这种情况, 在我们常用递变这个词来表示.
不过, 当年在门捷列夫初次排出周期表的时候, 那张表还不像现在这么完整.因为, 当时人们只知道63 种元素, 许多元素还没有被发现, 所以在门捷列夫排周期表的时候, 曾经碰到了许多困难.要不是他对科学的信仰, 要不是他有坚强的毅力, 要不是他具有非凡的预见, 要从当时那些杂乱无章的元素知识中找到这样的规律, 并排列出这张表来, 实在是不可能的.
教育新鲜事
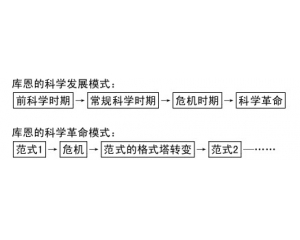 “复式”化学革命模式
“复式”化学革命模式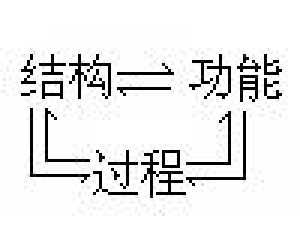 结构、过程与功能的相互
结构、过程与功能的相互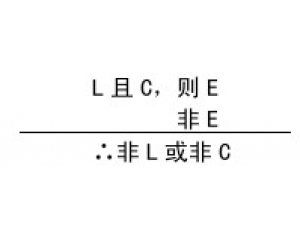 检验的复杂性
检验的复杂性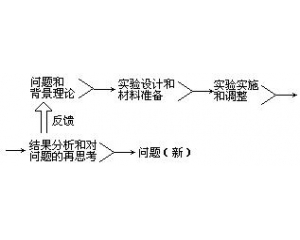 实验操作的程序
实验操作的程序