原子序数就是质子数
在莫斯莱以前, 有的科学家已经注意到, 用不同的元素做成的X 射线管中的靶子 (对阴级) , 发射出来的X 射线的穿透能力是不同的, 原子量越大的元素, 发出的X 射线的穿透能力越强.这种具有特殊穿透能力的X 射线被叫做特征X 射线.
1913 年到1914 年间, 莫斯莱系统地研究了各种元素的特征X 射线.他借助於一种叫做亚铁氰化钾的晶体, 摄取了多种元素的X 射线谱.他发现, 随着元素在周期表中的排列顺序依次增大, 相应的特征X 射线的波长有规则地依次减小.莫斯莱根据实验的结果认为, 元素在周期表中是按照原子序数而不是按照原子量的大小排列的, 原子序数等於原子的核电荷数.
原子序数原来就是原子核里的核电荷数! 莫斯莱的这个发现, 第一次把元素在周期表里的座位和原子结构科学地联系在一起了.这个发现, 给科学家们展现了一个广阔的研究领域.可惜的是, 这位勤奋而又有才能的青年科学家, 竟然在27 岁的时候, 就牺牲在第一次世界大战的战场上了.
后来, 在发现了质子和中子以后, 人们终於认识到, 决定一个元素在周期表中的位置的, 只是它的原子核中的质子数.
例如, 氢元素的原子核里只有1 个质子, 核电荷数是l, 所以它必然就排在周期表里的第1 位.碳元素的原子核里有6 个质子, 核电荷数是6, 因此它就应该排在周期表里的第6 位.而钾元素的原子核里共有19 个质子, 核电荷数是19, 当然它就是周期表里的第19 号元素了.
反过来也一样, 周期表里第几位上的元素, 原子核里一定有几个质子.例如, 氯是周期表里的第17 号元素, 它的原子核里也就有17 个质子, 核电荷数自然也就是17.
可以说, 有了这个发现, 就解开了周期表当中几个长期叫人困惑的谜! 第1 个被解开的谜, 就是那个让人大伤脑筋的问题——氢和氦之间还能不能再有新元素.
根据这个发现, 人们知道氢原子核里只有1 个质子, 应该排在周期表里的第1 位, 而氦原子核里有2 个质子, 当然应该占据第2 位, 虽然在周期表上它们的中间隔着好大一块空地, 可是质子数在1 和2 之间的原子, 可以肯定不会再有了.
第2 个被解开的谜, 就是几对元素的顺序倒置问题.前面已经说过, 门捷列夫在发现元素周期律的时候, 是按照元素的原子量大小的顺序编排元素的.按照当时大多数化学家测定的数值, 钴的原子量是59, 镍的原子量是58.7;碲的原子量是128, 碘的原子量是127.按照原子量大小的顺序, 镍应当排在钴的前面, 碘应当排在碲的前面.可是, 按照同族元素应该具有相似的性质这个规律 (拿化合价来说, 碲的最高价为+6 价, 应当同硫、硒等排在一族;碘的最高价为+7 价, 应当同氯、溴等排在一族) , 他们排列的次序就应该颠倒过来.后来, 还有氩 (39.9) 排在钾 (39.1) 的前面和钍 (232) 排在镤 (231) 的前面这两个原子量的顺序颠倒的问题.
不过, 当年门捷列夫对於元素的性质随着原子量的增大而发生周期性的变化这一点是深信不疑的, 他始终认为一定是人们把钻和镍、碲和碘、氩和钾的原子量测定错了.所以, 在他自己排的周期表中仍然是把钴放在镍的前面, 把碲放在碘的前面, 把氩放在钾的前面.他在生前一直在期待着化学家给钾、镍和碘增大原子量, 或者给氩、钴和碲减小原子量.但是, 它们的原子量确实是氩大於钾, 钴大於镍, 碲大於碘.所以, 多少年来, 这个所谓的顺序倒置问题就成了一个不解之谜.
现在, 莫斯莱等人的新的发现, 一下子就解决了这个难题: 元素在周期表中应该按照它的原子序数, 也就是按照原子核中质子数的顺序来排列, 而不应当按照原子量的大小来排列.
钾原子核里的质子数恰好比氩多1、碘比碲多1, 镍又比钻多1.所以, 氩和钾、碲和碘、钴和镍的顺序完全是正确的, 并不存在什么颠倒问题.不过, 这个问题总让人觉得没有彻底解决.因为绝大多数的元素都随着原子序数的增大, 随着质子数的增多, 原子量也相应地增大.只有这几对元素的原子量没有按照这个顺序增大, 反而是原子量大的排在了前面, 原子量小的排在了后面, 这是为什么?
后来弄清楚了, 这个问题的关键也是在原子核里.
原来, 同一种元素的原子核里面具有相同数目的质子, 也就是具有相同的核电荷数, 核外的电子数目和它们的分布状况当然也完全相同, 因而就具有相同的化学性质.而不同元素的质子数一定不同, 核电荷数和核外电子数也一定不同, 它们的化学性质也就不同了.因此, 在化学上给元素下的定义是: 含有相同质子数目的一类原子的总称.
可是, 对於原子核的进一步研究却发现, 同一种元素的的原子里, 质子数虽然一样多, 但中子的数目却不完全相同.
拿氢元素来说吧, 它所有的原子里, 都只有1 个质子, 可中子数却不一样.有的氢原子里根本没有中子, 有的氢原子里有1 个中子, 还有的氢原子里竟然有两个中子! 这3 种氢原子的化学性质几乎完全一样, 很难区别.就好像一胎生下来的3 个孪生兄弟——三胞胎, 长的一模一样.中子数不同的氢原子就是原子世界中的三胞胎.
原子也有多胞胎!
原子里的多胞胎, 质子数完全一样, 属於同一种元素, 在周期表上当然占据同一个位置, 因此, 人们也把它们叫做同位素.
同一种元素的几个同位素虽然化学性质相同, 但在物理性质上却不完全相同.比如, 它们的原子质量就一定各不相同.那些在原子核中含中子多的原子, 原子质量就大些, 含中子少的原子, 原子质量就要小些.
在氢的同位素中, 不含中子的称为氢—1, 含有1 个中子的称为氢—2, 含两个中子的称为氢—3.这就好像三胞胎的妈妈把她的孩子们叫成老大、老二、老三一样.当然, 这是小名.它们除了小名以外, 还各有各的大名.氢—1 叫做氕, 氢—2 叫做氘, 氢—3 叫做氚.
氕、氘、氚虽然各自的原子质量不同, 但它们的化学性质几乎完全相同.在自然界里, 它们也都混在一起, 难分难解.所以, 平时我们所测出来的氢的原子量, 就是这3 种原子质量的平均值.
现在已经知道, 绝大多数的元素都有两种或两种以上的同位素.因此, 绝大多数元素的原子量, 都是它的各种同位素的原子质量的平均值.
自然界的各种元素, 一般来说, 质子数大的, 原子量也比较大;质子数少的, 原子量也比较小.所以, 在周期表中, 大多数元素都是随着质子数的增大, 原子量也同时增大.可是, 有的元素, 虽然质子数较小, 但是在自然界, 它的几个同位素中较重的同位素占的比例大, 因而几种同位素的原子质量的平均值 (就是这种元素的原子量) 也就要大些.而有的元素虽然质子数比较大, 但由於较重的同位素占的比例小, 结果这种元素的原子量反倒要小一些了.
拿氩和钾这一对元素来说, 氩的质子数 (18) 要比钾的质子数 (19) 小, 但是在自然界中, 它的重同位素占的比例大——氩-40 占99.60%, 它的原子质量为39.96 个原子质量单位 (u) , 氩-38 占0.06%, 它的原子质量为37.96% (u) , 氩-36 占0.34%, 它的原子质量为35.97 (u) .很容易计算, 氩的原子量应该是:
(39.96 × 99.60 + 37.96 × 0.96 + 35.97 × 34) /100=39.95
钾的质子数虽然较大, 但它的重同位素占的比例小——钾-41 占6.88%, 它的原子质量为40.96 (u) , 钾-40 占0.01%, 它的原子质量为39.96(u) , 钾-39 占93.08%, 它的原子质量为38.96 (u) .所以, 钾的原子量就是:
(40.96 × 6.88 + 39.96 × 0.01 + 38.96 × 93.08) /100=39.10
这样一来, 从原子量看, 在周期表中排在后面的钾反倒比排在前面的氩要小, 这就是曾经在一个相当长的时期里解释不了的顺序倒置问题.在同位素被发现以后, 特别是在原子核的质子中子结构被阐明以后, 这个问题就很容易理解了.钴和镍、碲和碘、钍和镤的倒置问题, 也都是由於同样的原因造成的.这个谜终於被彻底解开了!
教育新鲜事
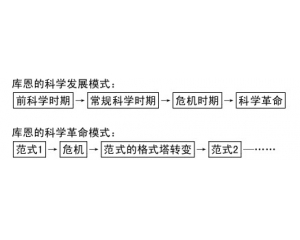 “复式”化学革命模式
“复式”化学革命模式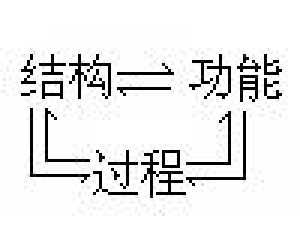 结构、过程与功能的相互
结构、过程与功能的相互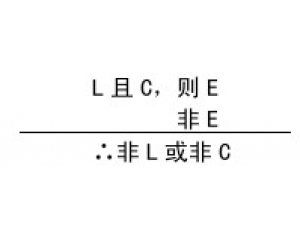 检验的复杂性
检验的复杂性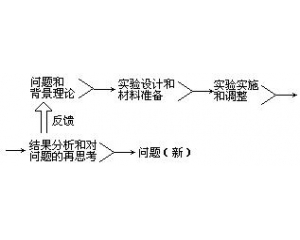 实验操作的程序
实验操作的程序