倍比定律
普鲁斯特和贝索勒的争论,说明了这样的一个事实:两种元素能够以不同的比数化合生成不同的化合物。然而,这也就随着产生了一个新的问题:这两种元素能不能以任意的比数生成许多种化合物呢?在各种不同的化合物之间,是不是又存在着一定的关系呢?答案是:两种元素只能生成有限的几种不同的化合物,并不能以任意的比数生成许多种化合物。而且,在各种不同的化合物之间,存在着一定的比数关系。这一规律,是英国化学家道尔顿在1803年发现的。
当时,道尔顿在埋头于气体成分的研究工作中,研究了许许多多气体相互化合所生成的化合物。在工作中,他发现两种元素可以生成两种或两种以上的不同的化合物。他仔细地把这些不同的化合物加以对比,看出了一条崭新的规律来:元素的化合的比数,常常可以约成简单的整数。以氮气和氧气为例,它俩互相化合,可以生成5种不同的氮氧化合物。如果以氮的重量为1作标准,可以得到下面的结果: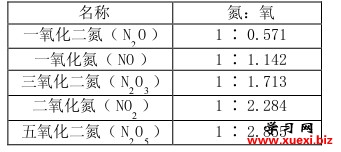
如果你拿出一张纸来,把0.571、1.142、1.713、2.284、2.855都用0.571除一下的话,可以看出,这5种化合物中氧的含量恰巧是1∶2∶3∶4∶5。再以铅和氧的化合物为例:如果用1克铅,在空气中加热到摄氏500度,那么,铅和氧会化合生成红色的四氧化三铅(俗名“红丹”,Pb3O4)1.1029克;如果把1克铅,在空气中加热到摄氏750度,那么,铅会和氧化合生成黄色的一氧化铅(俗名叫“黄丹”,PbO)1.0772 克。在这里,所用的铅都是1克,而这两种化合物中所含的氧的重量是0.1029克和0.0772克。
它们之间的比数是 0.1029∶0.0772=4∶3(因为 0.1029=0.02573×4;0.0772=0.02573×3);恰好又成简单的整数比!这样,道尔顿得出了一个规律,用现代的说法,那就是:如果甲乙两种元素能够化合成几种化合物,那么,在这几种化合物里,跟一定量甲元素相化合的乙元素的几个量,一定互成简单的整数比。这个定律,便是著名的“倍比定律”。道尔顿是在1803年发现倍比定律的,但是,当时他并没有把这一定律公开发表。1804年,道尔顿同英国化学家托马斯·汤姆生的一次会晤中,谈起了自己的发现,汤姆生听了,非常高兴。
1808年,汤姆生在自己的《化学系统》这本书的第三版里,把道尔顿的发现写了进去。这样,倍比定律才第一次公布于世。道尔顿是一个慎重、谨严的科学家,他在当时不愿意马上公开发表自己的定律,也是有原因的——他感到有关的实验自己做得还不多。特别是在当时,普鲁斯特做了许多实验,这些实验的结果并不符合倍比定律。那时候,普鲁斯特曾分析了氧和铜的两种不同的化合物——氧化铜和氧化亚铜,得到这样的结果:氧化亚铜(红色,Cu2O)铜∶氧=100∶16(重量比,下同)氧化铜(黑色,CuO)铜∶氧=100∶25这里,氧在两种化合物中的重量是 16∶25,看不出成什么简单的整数,好象倍比定律对于铜和氧的化合物并不适用。正因为这样,道尔顿不愿意在问题还没有彻底弄清楚之前,就冒冒失失、轻率地发表自己的论文。也正因为这样,道尔顿在遇见汤姆生时,便向他讲述了自己的发现,并谦虚地向他请教。
在1811年到1812年之间,瑞典分析化学家、以分析数据精确著称的白则里,重新仔仔细细地重复做着普鲁斯特的工作——凡是普鲁斯特做过的实验,他都一一重新做过,核对过。终于发现普鲁斯特对氧化铜的成分的测定,是错误的。白则里做了实验,得到这样结果:红色氧化铜铜∶氧=100∶12.6黑色氧化铜铜∶氧=100∶25.2这里,两种化合物中氧的重量是12.6∶25.2即 1∶2,恰好成简单的整数比——完全符合倍比定律。普鲁斯特也正因为实验结果不准确,因此没能发现倍比定律。倍比定律,虽是道尔顿首先发现的,但是,这也和汤姆生、白则里的努力是分不开的。倍比定律,又是物质不灭定律的一个新的发展。
当时,道尔顿在埋头于气体成分的研究工作中,研究了许许多多气体相互化合所生成的化合物。在工作中,他发现两种元素可以生成两种或两种以上的不同的化合物。他仔细地把这些不同的化合物加以对比,看出了一条崭新的规律来:元素的化合的比数,常常可以约成简单的整数。以氮气和氧气为例,它俩互相化合,可以生成5种不同的氮氧化合物。如果以氮的重量为1作标准,可以得到下面的结果:

它们之间的比数是 0.1029∶0.0772=4∶3(因为 0.1029=0.02573×4;0.0772=0.02573×3);恰好又成简单的整数比!这样,道尔顿得出了一个规律,用现代的说法,那就是:如果甲乙两种元素能够化合成几种化合物,那么,在这几种化合物里,跟一定量甲元素相化合的乙元素的几个量,一定互成简单的整数比。这个定律,便是著名的“倍比定律”。道尔顿是在1803年发现倍比定律的,但是,当时他并没有把这一定律公开发表。1804年,道尔顿同英国化学家托马斯·汤姆生的一次会晤中,谈起了自己的发现,汤姆生听了,非常高兴。
1808年,汤姆生在自己的《化学系统》这本书的第三版里,把道尔顿的发现写了进去。这样,倍比定律才第一次公布于世。道尔顿是一个慎重、谨严的科学家,他在当时不愿意马上公开发表自己的定律,也是有原因的——他感到有关的实验自己做得还不多。特别是在当时,普鲁斯特做了许多实验,这些实验的结果并不符合倍比定律。那时候,普鲁斯特曾分析了氧和铜的两种不同的化合物——氧化铜和氧化亚铜,得到这样的结果:氧化亚铜(红色,Cu2O)铜∶氧=100∶16(重量比,下同)氧化铜(黑色,CuO)铜∶氧=100∶25这里,氧在两种化合物中的重量是 16∶25,看不出成什么简单的整数,好象倍比定律对于铜和氧的化合物并不适用。正因为这样,道尔顿不愿意在问题还没有彻底弄清楚之前,就冒冒失失、轻率地发表自己的论文。也正因为这样,道尔顿在遇见汤姆生时,便向他讲述了自己的发现,并谦虚地向他请教。
在1811年到1812年之间,瑞典分析化学家、以分析数据精确著称的白则里,重新仔仔细细地重复做着普鲁斯特的工作——凡是普鲁斯特做过的实验,他都一一重新做过,核对过。终于发现普鲁斯特对氧化铜的成分的测定,是错误的。白则里做了实验,得到这样结果:红色氧化铜铜∶氧=100∶12.6黑色氧化铜铜∶氧=100∶25.2这里,两种化合物中氧的重量是12.6∶25.2即 1∶2,恰好成简单的整数比——完全符合倍比定律。普鲁斯特也正因为实验结果不准确,因此没能发现倍比定律。倍比定律,虽是道尔顿首先发现的,但是,这也和汤姆生、白则里的努力是分不开的。倍比定律,又是物质不灭定律的一个新的发展。
教育新鲜事
 “复式”化学革命模式
“复式”化学革命模式 结构、过程与功能的相互
结构、过程与功能的相互 检验的复杂性
检验的复杂性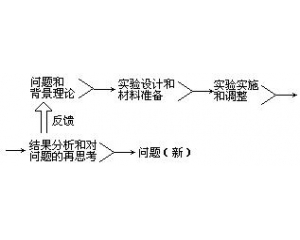 实验操作的程序
实验操作的程序