热力学第二定律和熵
自然界里的自发过程常常具有一定的方向性。例如热量只能从高温物体传递到低温物体;溶解的盐类总是从高浓度溶液向低浓度溶液扩散;水流总是从高压向低压流动;岩块总是从高位势向低位势移动等等。假设在上述例子中,那些自发过程可以以相反方向进行的话,那么它们的能量变化并不违背热力学第一定律的。如低温物体内能变小,高温物体内能变大,使热量从低温物体自发地传递到高温物体上去。但是,实践表明,这种情况是决不会出现的。说明制约自然界中自发过程进行的方向,除了第一定律外,还存在其他的制约因素。热力学第二定律正是阐明自发过程进行的方向的。第二定律有几种不同的表述。
例如,克劳修斯(Clausius,1850)的说法:不可能把热从低温物体传到高温物体而不引起其他变化。凯尔文(Kelvin,1851)的说法:不可能从单一热源取热使之完全变为有用功而不引起其他变化。此外还有一些其他的定性表述。为了定量表达第二定律,如同第一定律引入内能一样,第二定律引入了一个新的态函数——熵。体系在无限小的可逆过程中所吸收的热量δQR(R 表示可逆过程),除以传热时的温度T所得的商,定义为体系的微分熵变dS,即:

例如,克劳修斯(Clausius,1850)的说法:不可能把热从低温物体传到高温物体而不引起其他变化。凯尔文(Kelvin,1851)的说法:不可能从单一热源取热使之完全变为有用功而不引起其他变化。此外还有一些其他的定性表述。为了定量表达第二定律,如同第一定律引入内能一样,第二定律引入了一个新的态函数——熵。体系在无限小的可逆过程中所吸收的热量δQR(R 表示可逆过程),除以传热时的温度T所得的商,定义为体系的微分熵变dS,即:

教育新鲜事
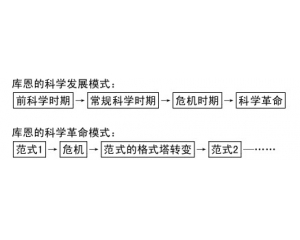 “复式”化学革命模式
“复式”化学革命模式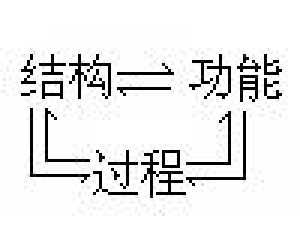 结构、过程与功能的相互
结构、过程与功能的相互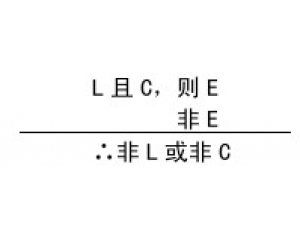 检验的复杂性
检验的复杂性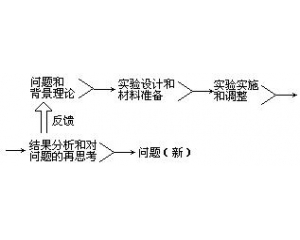 实验操作的程序
实验操作的程序