热力学第二定律和熵(2)
1)以孤立体系为条件,孤立体系的熵永不减少,孤立体系中进行可逆过程时熵不变,进行不可逆过程时熵增大。2)以绝热过程为条件,体系在任何绝热过程中熵不减少,在可逆过程中熵不变,在不可逆过程中熵增加。进而可以提出定量描述热力学平衡的熵判据,孤立体系(通常以等内能和等容为条件)抵达平衡则(△S)U,V=0,或(dS)U,V、=0,即为平衡判据;孤立体系自发演化的方向为(△S)U,V>0,或(dS)U,V>0,即为演化判据。体系熵值的实际意义可以理解为体系的有序度。体系的熵值增大表示体系的无序程序增加,或称混乱度增加。自然界自发过程通常是倾向于形成更加无序(或更加混乱)的结构。
由式(3.1),当体系仅有压力一体积功(或称pV功)时,第一定律表述为:dU=δQ-pdV(3.4)将式(3.3)代入式(3.4),dU=TdS—pdV(3.5)式(3.5)称为第一和第二定律的联合形式,它适用于封闭体系的可逆过程和不可逆过程。此式中包括了描述体系热力学性质的所有主要变量p,V,T,U和S,其他热力学变量都可以由它们推演而得。例如焓H、功函F和自由能G等,推演方法将在后面叙述。以熵S和体积V为变量的内能U的态函数称为特征函数,因为由该函数可以推演体系其他的平衡性质。

由式(3.1),当体系仅有压力一体积功(或称pV功)时,第一定律表述为:dU=δQ-pdV(3.4)将式(3.3)代入式(3.4),dU=TdS—pdV(3.5)式(3.5)称为第一和第二定律的联合形式,它适用于封闭体系的可逆过程和不可逆过程。此式中包括了描述体系热力学性质的所有主要变量p,V,T,U和S,其他热力学变量都可以由它们推演而得。例如焓H、功函F和自由能G等,推演方法将在后面叙述。以熵S和体积V为变量的内能U的态函数称为特征函数,因为由该函数可以推演体系其他的平衡性质。

教育新鲜事
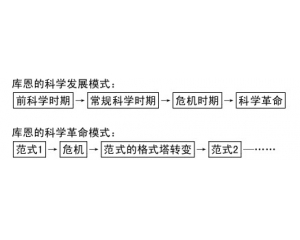 “复式”化学革命模式
“复式”化学革命模式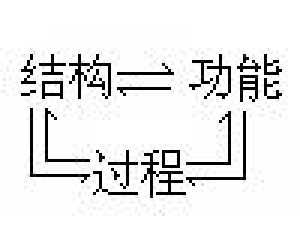 结构、过程与功能的相互
结构、过程与功能的相互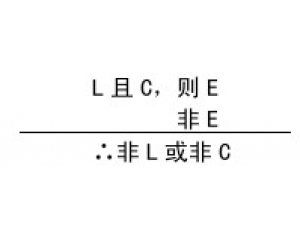 检验的复杂性
检验的复杂性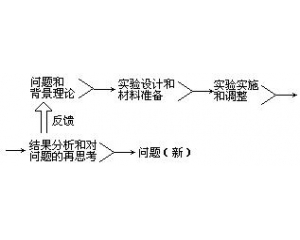 实验操作的程序
实验操作的程序