亨利定律、拉乌尔定律
亨利定律是稀溶液所遵循的最重要、最有意义的规律。其表述为“在一定条件下,稀溶液中溶质的活度与溶质在溶液中的摩尔分数成正比”。表达式为:其中a1为溶质i的活度,X1为溶质i在稀溶液中的摩尔分数,K1称为亨利系数,这个常数取决于溶质和溶剂的双方性质。拉乌尔定律是稀溶液所遵循的另一规律,它是基于在溶剂中加入非挥发性溶质后溶剂活度降低而得出的。其表述为“稀溶液中溶剂的活度等于纯溶剂的活度乘以溶液中溶剂的摩尔分数”,溶剂在全部浓度范围内都符合拉乌尔定律的溶液称为理想溶液。
除极少数情况外,一般溶液都不具有理想溶液性质。溶液的活度—组分摩尔分数的关系。由图可知,亨利系数为实际溶液对理想溶液的偏离程度的修正。遵循亨利定律的稀溶液也属非理想溶液范畴,只不过在较低的摩尔分数区间,亨利系数为一恒定常数,它一般小于 1。而且溶液越稀,即溶质摩尔分数越低,就愈可能符合亨利定律。这就是说,在一定条件下,非理想溶液的稀溶液可由亨利定理来描述,当某微量元素(溶质)超过一定浓度时,它将不服从亨利定律。
除极少数情况外,一般溶液都不具有理想溶液性质。溶液的活度—组分摩尔分数的关系。由图可知,亨利系数为实际溶液对理想溶液的偏离程度的修正。遵循亨利定律的稀溶液也属非理想溶液范畴,只不过在较低的摩尔分数区间,亨利系数为一恒定常数,它一般小于 1。而且溶液越稀,即溶质摩尔分数越低,就愈可能符合亨利定律。这就是说,在一定条件下,非理想溶液的稀溶液可由亨利定理来描述,当某微量元素(溶质)超过一定浓度时,它将不服从亨利定律。
相关文章
教育新鲜事
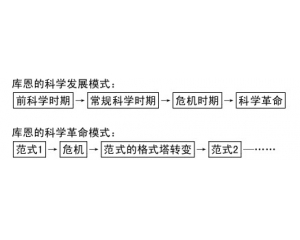 “复式”化学革命模式
“复式”化学革命模式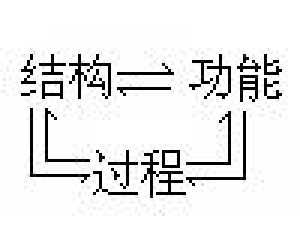 结构、过程与功能的相互
结构、过程与功能的相互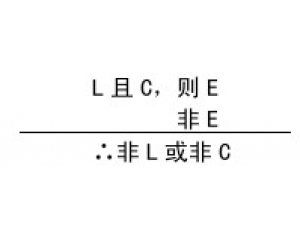 检验的复杂性
检验的复杂性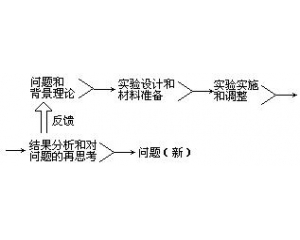 实验操作的程序
实验操作的程序