同位素平衡分馏
当体系处于同位素平衡时,同位素在两种或两种以上物相间的分馏称为同位素平衡分馏,这时可以不考虑分馏的具体机理,而把所有的平衡分馏看作是同位素交换反应的结果。同位素交换反应和普通化学反应一样,可列出反应方程式,如氯化氢溶解到重水中:

平衡常数和分馏系数是二个不同概念的常数,前者是对某一交换反应而言,指在平衡时反应前后各组份浓度分布关系。后者是对某一分馏过程而言,指把一个体系分成二部分时,同位素浓度分布的比例关系,这个分馏过程可以是一个简单的交换反应,也可以是包含若干反应的复杂情况。对于如式(7.4)那样的只有一个同位素原子参加交换反应的反应中,平衡 分 馏 系 数 等 于 反 应 的 平 衡 常 数 , 即 α =K 。 对 于 有


平衡常数和分馏系数是二个不同概念的常数,前者是对某一交换反应而言,指在平衡时反应前后各组份浓度分布关系。后者是对某一分馏过程而言,指把一个体系分成二部分时,同位素浓度分布的比例关系,这个分馏过程可以是一个简单的交换反应,也可以是包含若干反应的复杂情况。对于如式(7.4)那样的只有一个同位素原子参加交换反应的反应中,平衡 分 馏 系 数 等 于 反 应 的 平 衡 常 数 , 即 α =K 。 对 于 有
教育新鲜事
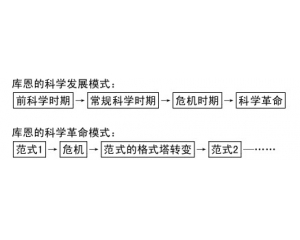 “复式”化学革命模式
“复式”化学革命模式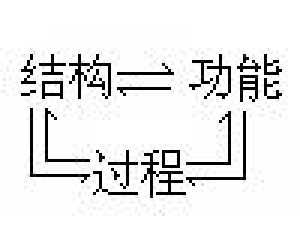 结构、过程与功能的相互
结构、过程与功能的相互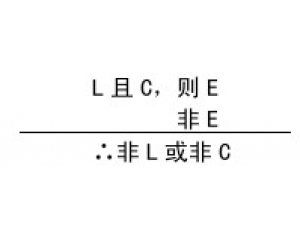 检验的复杂性
检验的复杂性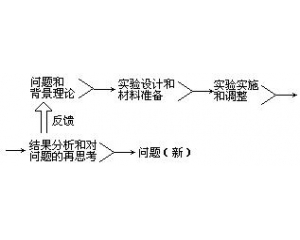 实验操作的程序
实验操作的程序