乙烯的制取和性质
目的:认识乙烯的实验室制法和性质。
用品:蒸馏烧瓶、分液漏斗、双孔塞、温度计(200℃)、石棉网、导管、洗气瓶、水槽、集气瓶、玻璃片、试管、烧杯、玻璃棒、量筒。浓硫酸、乙醇、氢氧化钠溶液(10%)、溴水(3%)、高锰酸钾溶液(0.5%)、液溴、稀硫酸(1∶4)。
原理:实验室里通常用浓硫酸使乙醇脱水而制得乙烯。硫酸应过量,用3摩尔硫酸和1摩尔乙醇的比例混和。
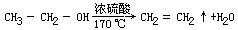
操作:1.乙烯的制取在250毫升的蒸馏烧瓶里铺上一层洁净而干燥的碎瓷片,既作催化剂又可防止暴沸,加入20毫升乙醇,然后慢慢地加入浓硫酸60毫升,振荡使其充分混和。如果混和液温度较高,可以把烧瓶浸在冷水里冷却。把仪器按图9-4装置好,把蒸馏烧瓶的导管顺次跟盛有浓硫酸(除去乙醇和乙醚的蒸气)和10%的氢氧化钠除去二氧化碳、二氧化硫的洗气瓶连接,插入 200℃的水银温度计,使水银球浸没在乙醇和浓硫酸的混和液里。另外在烧杯里先加入乙醇10毫升,再慢慢地加入浓硫酸10毫升,边加边用玻棒搅动混和,边浸在冷水中冷却。然后把这混和液加入装在烧瓶上的分液漏斗里。一开始就用酒精灯强热烧瓶,使温度急速上升,很快就越过 160℃。当洗气瓶里有连续的、均匀的气泡冒出时,再缓缓地加热。随着反应的不断进行,反应物逐渐减少,此时可从分液漏斗里慢慢地将混和液加入烧瓶中,补充反应物并起冷却作用。因烧瓶里乙醇的比量逐渐减少,硫酸的比量相对增高,所以新加进去的混和液用1∶1。
2、乙烯的化学性质
(1)加成反应:把乙烯通入盛有3毫升溴水的试管里,溴水的颜色很快褪去。或在充满乙烯的集气瓶里,注入少量溴水,盖上玻片,振荡,溴水的红棕色很快消失。把玻璃片稍打开一些,可以听到有空气冲进瓶里发出“嘶”的声音。
(2)氧化反应:把乙烯通入盛有3毫升高锰酸钾溶液(加几滴稀硫酸)的试管里,紫色立即褪去。高锰酸钾溶液必须是稀的,否则会使溶液变成暗褐色。点燃纯净的乙烯,它能在空气里燃烧,有明亮的火焰。同时发出黑烟。
注意事项:1.制取乙烯时先要检查装置的气密性,以防加热时由于漏气而引起燃烧。
2.反应物进行混和时,应把浓硫酸慢慢注入酒精中,而不能相反。
3.浓硫酸和乙醇的混和物加热到130~140℃时有乙醚生成,因此要控制反应温度,抑制乙醚的生成。加热到 150℃以上开始生成乙烯。所以实验一开始就要强热,迅速把温度提高到150℃以上,最好控制在170℃。
4.可在反应容器里加一些用盐酸洗净的干燥砂子、碎瓷片、碎玻璃片或其它惰性固体物质。这些物质既可起催化剂的作用,还可防止反应混和物受热时产生暴沸现象。
5.浓硫酸既是脱水剂,也是氧化剂,在反应过程中可以使乙醇氧化成一氧化碳、二氧化碳和碳等,因此,混和液加热后会变黑,而硫酸本身被还原成二氧化硫。生成的气体随着乙烯一起出来,二氧化硫也能使溴水和高锰酸钾溶液褪色,但可通过氢氧化钠溶液把它除去,二氧化碳也可以被碱溶液吸收。这时的乙烯虽然还夹杂有少量的一氧化碳,但它对乙烯的性质实验已没有影响了。
6.乙烯点燃前应检验气体的纯度。其它实验方法:
1.如果不要除去乙烯中的杂质气体,可以用如下的简单装置来制备。图中乙不能控制温度,只要看到混和液体发黑,便可以收集乙烯。
2.实验室还可以用氧化铝使乙醇脱水的方式来制取乙烯。取10克铝片用砂纸擦去表面的氧化膜后,浸在 20%的氯化汞溶液中,待表面有汞析出时,取出并置于空气中会很快产生毛刷状的氧化铝细丝,即可备用。
新制的硅酸铝作催化剂效果很好。将 5 克 AlCl3·6H2O 和 8.5 克Na2SiO3·9H2O分别溶于水制成饱和溶液,然后混和,生成白色Al2(SiO3)3沉淀,经过滤、洗涤(洗至无 Cl-,用倾泻法洗涤亦可)、灼烧,即可供使用。用新制Al2(SiO3)3和灼烧过的市售Al2O3混和(比例1∶1)作催化剂,效果也很好。
用品:蒸馏烧瓶、分液漏斗、双孔塞、温度计(200℃)、石棉网、导管、洗气瓶、水槽、集气瓶、玻璃片、试管、烧杯、玻璃棒、量筒。浓硫酸、乙醇、氢氧化钠溶液(10%)、溴水(3%)、高锰酸钾溶液(0.5%)、液溴、稀硫酸(1∶4)。
原理:实验室里通常用浓硫酸使乙醇脱水而制得乙烯。硫酸应过量,用3摩尔硫酸和1摩尔乙醇的比例混和。
操作:1.乙烯的制取在250毫升的蒸馏烧瓶里铺上一层洁净而干燥的碎瓷片,既作催化剂又可防止暴沸,加入20毫升乙醇,然后慢慢地加入浓硫酸60毫升,振荡使其充分混和。如果混和液温度较高,可以把烧瓶浸在冷水里冷却。把仪器按图9-4装置好,把蒸馏烧瓶的导管顺次跟盛有浓硫酸(除去乙醇和乙醚的蒸气)和10%的氢氧化钠除去二氧化碳、二氧化硫的洗气瓶连接,插入 200℃的水银温度计,使水银球浸没在乙醇和浓硫酸的混和液里。另外在烧杯里先加入乙醇10毫升,再慢慢地加入浓硫酸10毫升,边加边用玻棒搅动混和,边浸在冷水中冷却。然后把这混和液加入装在烧瓶上的分液漏斗里。一开始就用酒精灯强热烧瓶,使温度急速上升,很快就越过 160℃。当洗气瓶里有连续的、均匀的气泡冒出时,再缓缓地加热。随着反应的不断进行,反应物逐渐减少,此时可从分液漏斗里慢慢地将混和液加入烧瓶中,补充反应物并起冷却作用。因烧瓶里乙醇的比量逐渐减少,硫酸的比量相对增高,所以新加进去的混和液用1∶1。
2、乙烯的化学性质
(1)加成反应:把乙烯通入盛有3毫升溴水的试管里,溴水的颜色很快褪去。或在充满乙烯的集气瓶里,注入少量溴水,盖上玻片,振荡,溴水的红棕色很快消失。把玻璃片稍打开一些,可以听到有空气冲进瓶里发出“嘶”的声音。
(2)氧化反应:把乙烯通入盛有3毫升高锰酸钾溶液(加几滴稀硫酸)的试管里,紫色立即褪去。高锰酸钾溶液必须是稀的,否则会使溶液变成暗褐色。点燃纯净的乙烯,它能在空气里燃烧,有明亮的火焰。同时发出黑烟。
注意事项:1.制取乙烯时先要检查装置的气密性,以防加热时由于漏气而引起燃烧。
2.反应物进行混和时,应把浓硫酸慢慢注入酒精中,而不能相反。
3.浓硫酸和乙醇的混和物加热到130~140℃时有乙醚生成,因此要控制反应温度,抑制乙醚的生成。加热到 150℃以上开始生成乙烯。所以实验一开始就要强热,迅速把温度提高到150℃以上,最好控制在170℃。
4.可在反应容器里加一些用盐酸洗净的干燥砂子、碎瓷片、碎玻璃片或其它惰性固体物质。这些物质既可起催化剂的作用,还可防止反应混和物受热时产生暴沸现象。
5.浓硫酸既是脱水剂,也是氧化剂,在反应过程中可以使乙醇氧化成一氧化碳、二氧化碳和碳等,因此,混和液加热后会变黑,而硫酸本身被还原成二氧化硫。生成的气体随着乙烯一起出来,二氧化硫也能使溴水和高锰酸钾溶液褪色,但可通过氢氧化钠溶液把它除去,二氧化碳也可以被碱溶液吸收。这时的乙烯虽然还夹杂有少量的一氧化碳,但它对乙烯的性质实验已没有影响了。
6.乙烯点燃前应检验气体的纯度。其它实验方法:
1.如果不要除去乙烯中的杂质气体,可以用如下的简单装置来制备。图中乙不能控制温度,只要看到混和液体发黑,便可以收集乙烯。
2.实验室还可以用氧化铝使乙醇脱水的方式来制取乙烯。取10克铝片用砂纸擦去表面的氧化膜后,浸在 20%的氯化汞溶液中,待表面有汞析出时,取出并置于空气中会很快产生毛刷状的氧化铝细丝,即可备用。
新制的硅酸铝作催化剂效果很好。将 5 克 AlCl3·6H2O 和 8.5 克Na2SiO3·9H2O分别溶于水制成饱和溶液,然后混和,生成白色Al2(SiO3)3沉淀,经过滤、洗涤(洗至无 Cl-,用倾泻法洗涤亦可)、灼烧,即可供使用。用新制Al2(SiO3)3和灼烧过的市售Al2O3混和(比例1∶1)作催化剂,效果也很好。
推荐内容
教育新鲜事
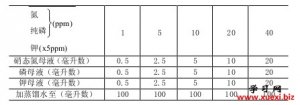 土壤有效养分的化学速测
土壤有效养分的化学速测 利用阿斯匹林进行几种有
利用阿斯匹林进行几种有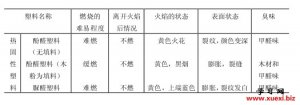 用燃烧法鉴别几种常用的
用燃烧法鉴别几种常用的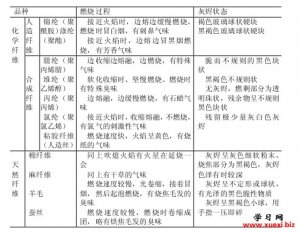 用燃烧法鉴别各种纤维
用燃烧法鉴别各种纤维