2017年高考化学复习指导——化学实验设计与评价
实验方案的设计与评价是一个综合性比较强的内容,包括了化学实验基本方法、元素及化合物知识、化学反应基本原理、有机化学等;在解题过程中,理清思路,找准方法,拆散解答。
☆★考点一:性质实验方案的设计与评价

(9)证明醇羟基 与羧酸发生酯化反应,其产物不溶于水,有果香味。
(10)比较金属的活动性 ①与水反应。②与酸反应。③置换反应。④原电池。⑤电解放电顺序。⑥最高价氧化物的水化物的碱性强弱。⑦对应盐溶液的酸碱性强弱。
(11)比较非金属的活动性 ①置换反应。②与氢气反应快慢。③气态氢化物的稳定性。④最高价氧化物的水化物的酸性强弱。
(12)比较酸(碱)的酸(碱)性强弱 较强的酸(碱)能制得较弱的酸(碱)。
【例1】【2015重庆理综化学】(15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过题9图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
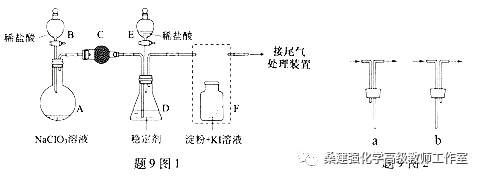
(1)仪器D的名称是 。安装F中导管时,应选用题9图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。 为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 ,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
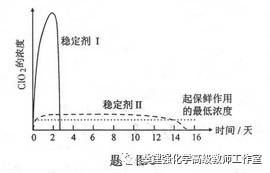
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如题9图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。
☆★考点二:制备实验方案的设计与评价
1、设计思路
2、解题策略
实验方案设计要求学生联系所学过的实验知识,实验技能以及实际条件,进行知识类比、迁移、重组。合理、周密地思考才能设计出正确的实验方案。
(1)思考问题的顺序:
①思考完成实验的最佳途径:由原料到产品,制取方法不止一种,选择适当的实验途径、实验用品是实验成败的关键.
②思考有关物质的制备、净化、吸收和存放等问题.例如,制取在空气中易水解的物质(如Al2S3、AlCl3、Mg3N2等)及易受潮的物质时,往往在装置的末端接一个干燥装置,以防止空气中水蒸气进入.
③思考合理组装仪器.例如:涉及到气体的制备和处理时,实验的操作程序及装置的连接顺序应为:发生→除杂质→干燥→尾气处理.

③复分解反应:如制HF、HCl、H2S、SO2、CO2、HNO3、H3PO4等.
④加热法:2HgO△2Hg+O2↑
MgCO3△MgO+CO2↑
2KClO3MnO22KCl+3O2↑
(3)掌握各类无机物、有机物之间的相互联系及内在规律,各类物质相互反应的客观规律,在生产、实验上有很重要的意义,可以指导无机物、有机物的制备.
【例2】【2016年高考江苏卷】(15分)实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3·3H2O。实验过程如下:
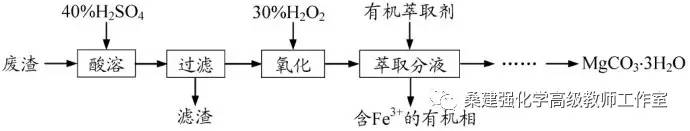
(1)酸溶过程中主要反应的热化学方程式为
MgCO3(s)+2H+(aq)===Mg2+(aq)+CO2(g)+H2O(l) ΔH=-50.4 kJ·mol-1
Mg2SiO4(s)+4H+(aq)===2 Mg2+(aq)+H2SiO3(s)+H2O(l) ΔH=-225.4 kJ·mol-1
酸溶需加热的目的是______;所加H2SO4不宜过量太多的原因是_______。
(2)加入H2O2氧化时发生发应的离子方程式为___________。
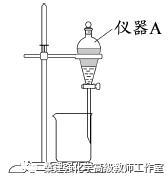
(3)用右图所示的实验装置进行萃取分液,以除去溶液中的Fe3+。
①实验装置图中仪器A的名称为_______。
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,______、静置、分液,并重复多次。
(4)请补充完整由萃取后得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,______,过滤、用水洗涤固体2~3次,在50℃下干燥,得到MgCO3·3H2O。
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全]。
☆★考点三:定量实验的设计与评价
定量实验是将化学实验方法与化学计算相结合的一种考查形式,课本上定量实验包括:一定物质的量浓度溶液的配制、酸碱中和滴定、胆矾中结晶水含量的测定、中和热的测定等,在近几年高考中常考到如相对原子(分子)质量的测定、纯度的测定、酸碱中和(氧化还原)滴定等。在解决此类问题需要注意几点:
(1)保证测定结果具有较高的准确度和精确度;
(2)实验过程中的隐蔽性操作,如必要的干燥、除杂、冷凝、静置、振荡等不能忽略;
(3)实验结构的分析,注意分析实验的关键、细节以及产生误差的因素等
(4)所需药品应准确描述,如粉末、固体、溶液、饱和、澄清、酸性、浓、稀、浓度值以及仪器的规格等。
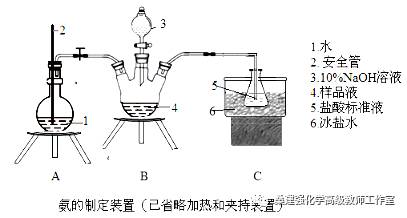
【例3】【2014年高考新课标Ⅱ卷第28题】(15分)某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
1.【2016年高考江苏卷】(14分)铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示0。
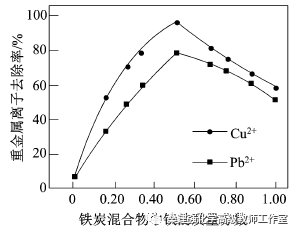
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是__________。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是_____________。
(3)纳米铁粉可用于处理地下水中的污染物。
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为 。
②纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O
研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是 。
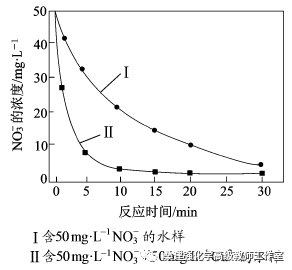
③相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见右图),产生该差异的可能原因是 。
2.【2016年高考上海卷】(本题共12分)
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。
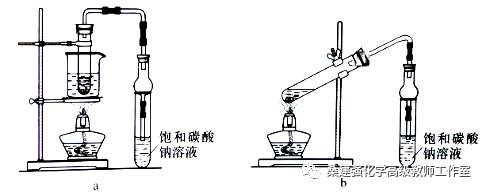 完成下列填空:
完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是______________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______________;浓硫酸用量又不能过多,原因是____________。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,_________、________,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
相关文章
- 【知识点】高考化学考点:分散系、胶体与溶液的概念及关系
- 高考化学必背67个离子方程式,你都会背了吗?
- 【收藏】高中化学全部“过量、少量”问题化学方程式总结
- 高中化学常见物质颜色归纳
- 学会三大守恒,搞定90%高考化学题!
- 高考化学40个常错知识点
- 最全汇总!八种化学计算题解题方法
- 化学 “一招”击毙高考化学6类易错点!
- 高一化学上册期中元素及其化合物易错知识点
- 高一化学必修一知识点汇集
- 学会积累总结,化学其实很容易拿分
- 5分钟搞定化学三大守恒,不再受它折磨
- 高中化学实验现象80例分享(配方程式)
- 高中化学最全知识体系精编,二轮查漏补缺必备
- 高中化学必背知识点归纳与总结
- 熟记化学中的这些“不一定”
- 高考化学考点解读——“实验操作、现象与结论”
- 高考化学考点解读——金属元素单质及其重要化合物
- 高考化学考点解读——非金属元素单质及其重要化合物
- 高考化学易错点
推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,