3.27高考化学你知道多少:非金属及其化合物六大基础知识2
四、二氧化硫和浓硫酸的性质
1.二氧化硫。
(1)具有酸性氧化物的通性。如与少量NaOH溶液发生反应SO2+NaOH= NaHSO3;与过量NaOH溶液发生反应SO2+2NaOH==Na2SO3+H2O。
(2)具有还原性,能被C2、Br2、I2、O2、FeCl3、KMnO4等氧化剂氧化。
① 与卤水反应:SO2+X2+2H2O==2HX+H2SO3(X为Cl、Br、I)。
② 与O2反应:2SO2+O2=催化剂,加热=2SO3。
③与FeCl3溶液反应:SO2+ 2FeCl3+ 2H2O == H2SO4+ 2FeCl2+2HCI(溶液由棕黄色变为浅绿色)。
(3)具有氧化性。如与H2S发生反应SO2+2H2S==3S +2H2O。
(4)具有漂白性。使品红溶液褪色,原理是SO2+有色物质— →无色物质— 加热或见光→有色物质+SO2。
2.浓硫酸的特性。
(1)在一定条件下,浓硫酸能氧化除Pt、Au以外的几乎所有金属,其还原产物是SOz,而不是Hz。
(2)在常温下,Fe、A1遇浓硫酸发生钝化。钝化并不是不反应,而是浓硫酸使铁、铝表面形成一层致密的氧化物薄膜,阻止了浓硫酸与内层金属继续反应。钝化体现了浓硫酸的强氧化性。
(3)浓硫酸使蓝矾(CuSO ·5H2O)变成白色粉末,体现了浓硫酸的吸水性。
(4)浓硫酸与金属单质反应时,体现了浓硫酸的氧化性和酸性;而与碳等非金属单质反应时,只体现浓硫酸的强氧化性。
例题5:下列叙述正确的是( )。
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有还原性的气体,如HI、H2S等
B.浓硫酸与硫单质可发生反应2H2SO4 (浓)+S3=△=3SO2↑+2H2O,在此反应中,浓硫酸既表现强氧化性,又表现酸性
C.把足量铜粉投入到含2 mol H2SO4 的浓硫酸中,加热充分反应,得到气体的体积(在标准状况下)为22.4 L
D.在常温下能够用铁、铝容器盛放浓硫酸,是因为浓硫酸能氧化铁、铝使其钝化
答案:D
解析:A项,浓硫酸不能用来干燥具有还原性的气体和碱性气体(如NH3);B项,浓硫酸与金属单质反应时,生成相应的盐和SO2,此时浓硫酸表现酸性和强氧化性,而与S、C等非金属单质反应时,由于没有盐生成,故只表现强氧化性。C项,浓硫酸与Cu反应时,浓硫酸的浓度逐渐降低,最终变为稀硫酸,反应自行停止,故产生的SO2在标准状况下的体积少于22.4 L
五、氨气的还原性
1.原理。在NH3中,氮元素显一3价,在适当的条件下,NH3与氧化剂相遇,可以发生氧化还原反应,使NH3中的氮元素化合价升高。
2.实验探究。
(1)氨气的催化氧化(实验装置如下图所示)。
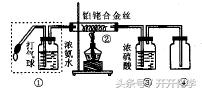
(2)装置的作用或现象。① 提供氨气和氧气。② 铂铑合金丝作催化剂,使氨气催化氧化。③ 吸收
剩余的氨气和生成的水蒸气。④观察到无色的气体变成红棕色。
(3)氨被氯气氧化。发生反应2NH3+3Cl2=△=N2+ 6HCl,8NH3+ 3Cl2=△=N2++ 6NH4Cl。
(4)氨被氧化铜氧化。发生反应2NH3+3CuO=△=3Cu+ N2+ 3H2O。
例题6:已知氨可以与灼热的氧化铜反应,得到氮气和金属铜,用下图所示的装置可以实现该反应。
请回答下列问题:
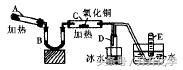
(1)A中加入的物质是 ______,发生反应的化学方程式是 ______。
(2)B中加入的物质是 ______,其作用是______ 。
(3)在C中观察到的现象是______ ,发生反应的化学方程式是______ 。
(4)在D中观察到的现象是______ ,D中收集到的物质是______ ,检验该物质的实验方法和出现的实验现象分别是______ ,______ 。
答案::(1)NH4Cl、Ca(OH) 2固体 2NH4Cl+Ca(OH)2== CaC12+2NH3↑+2H2O
(2)碱石灰(或CaO) 除去NH3中混有的水蒸气
(3)黑色粉末逐渐变为红色 2NH3+3CuO ==N2+3H2O+3Cu
(4)出现无色液体 氨水 用红色石蕊试纸检验试纸变蓝
解析:you题信息可知,A装置提供NH3且是“固体”+“固体”加热制备气体,则A中应加入NH4Cl、Ca(OH) 2固体,两者发生反应 2NH4Cl+Ca(OH)2== CaC12+2NH3↑+2H2O生成NH3
B装置是干燥装置,以除去NH3中的水蒸气,应加入碱石灰或CaO等碱性固体干燥剂。C装置中氨气被CuO氧化,现象为黑色粉末逐渐变为红色。反应生成的N2、水蒸气及未反应的NH3均会进入D试管中,因为水蒸气在冰水中会转化为液态水,氨气又极易溶于水,则D中收集到的是氨水。E装置收集到的是N2。
六、硝酸与金属单质的反应及相关计算
1.硝酸与金属单质反应的规律。
硝酸与金属单质反应时,一部分被还原,一部分转化成硝酸盐,故硝酸既表现氧化性又表现酸性,一般不生成H2。
(1)浓硝酸与铜的反应。随硝酸浓度的降低,还原产物会由NO 变成NO。但由氮原子守恒可知,无论是生成NO2,还是生成NO,被还原的HNO3的物质的量与生成的气体的物质的量一定相等。而未被还原的NO3-与Cu 2+结合成Cu(NO3) 2
(2)稀硝酸与铁的反应。
①Fe(少量)+4HNO3(稀)==Fe(NO3)3+ NO ↑+ 2H2O。
② 3Fe(过量)+8HNO (稀) 3Fe(NO3)2+2NO十+4H2O。
Fe少量时先发生反应① ,若Fe剩余再发生反应③ Fe+2Fe(NO3)2==3Fe(NO3)3,合并① ③ 即可得反应② 。所以,无论发生反应① ,还是发生反应② ,被还原的HNO3的量皆占参与反应的HNO3的量的1/4 。
2.硝酸与金属单质反应的有关计算方法。
(1)原子守恒法。硝酸与金属单质反应时,一部分HNO3起酸的作用,以NO3-的形式存在于溶液中;一部分HNO3作氧化剂转化为还原产物。这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量。
(2)电子守恒法。硝酸与金属单质的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属原子失去电子的物质的量。
(3)根据离子方程式计算法。金属单质与硫酸、硝酸的混合酸反应时,由于生成的硝酸盐中的NO3-在H2SO4提供H+的条件下,能继续与金属反应,所以,此类题目应根据离子方程式,先作过量判断,然后再根据量少的物质进行计算。
例题7:在标准状况下,将1.92 g铜粉投入到一定量的浓硝酸中,随着铜粉的溶解,反应生成的气体的颜色逐渐变浅,当铜粉完全溶解后,共收集到由NO和NO2组成的混合气体1.12L,则混合气体中NO的体积为( )。
A. 112 mL B. 1 008 mL
C. 224 mL D. 448 mL
答案:A
解析:由题意可得n(混合气)=0.05mol,n(Cu)=0.03mol。设NO的物质的量为n1 mol则NO2的物质的量为(0.05一n1 )mol,根据得失电子相等得3n1+(0.05一n1 )×1=0.03×2,解得n1=0.005。则 V(NO)=0.005 mol×22.4 L/mol=0.112L =112 mL。
课后习题巩固


推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,