高考化学考点解读——金属元素单质及其重要化合物
高考频度:★★★★★ 难易程度:★★★☆☆
下列关于元素及其化合物的说法正确的是
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应
B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同
C.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3
D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法
【参考答案】C
【试题解析】浓硝酸、浓硫酸都具有强氧化性,常温下能和铁发生钝化反应,无剧烈现象,铁和稀硝酸能发生剧烈反应,A错误;铝和氢氧化钠的反应为2Al+2NaOH+2H2O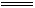 2NaAlO2+3H2↑,铝只作还原剂;Cl2+2NaOH
2NaAlO2+3H2↑,铝只作还原剂;Cl2+2NaOH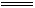 NaCl+NaClO+H2O,氯气既作氧化剂又作还原剂,两单质的作用不相同,B错误;Na的性质活泼,易与空气中氧气反应生成Na2O,反应为4Na+O2
NaCl+NaClO+H2O,氯气既作氧化剂又作还原剂,两单质的作用不相同,B错误;Na的性质活泼,易与空气中氧气反应生成Na2O,反应为4Na+O2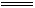 2Na2O,Na2O易与水反应生成NaOH,反应为Na2O+H2O
2Na2O,Na2O易与水反应生成NaOH,反应为Na2O+H2O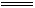 2NaOH,NaOH吸收空气中的水和CO2生成Na2CO3·xH2O,Na2CO3·xH2O风化脱水生成Na2CO3,C正确;由于FeCl3、CuCl2在加热过程中被促进水解,且生成的HCl又易挥发而脱离体系,造成水解完全,生成氢氧化铁、氢氧化铜,以致于得不到FeCl3、CuCl2,故D错误。
2NaOH,NaOH吸收空气中的水和CO2生成Na2CO3·xH2O,Na2CO3·xH2O风化脱水生成Na2CO3,C正确;由于FeCl3、CuCl2在加热过程中被促进水解,且生成的HCl又易挥发而脱离体系,造成水解完全,生成氢氧化铁、氢氧化铜,以致于得不到FeCl3、CuCl2,故D错误。
1.铝热反应的三个要点:
①中学化学中唯一一类金属单质与金属氧化物在高温条件下的置换反应。
②铝热剂是单质铝与难熔金属氧化物的反应,并不是Al与所有金属氧化物均能组成铝热剂,该金属氧化物对应的金属活泼性应比铝弱。
③引发铝热反应的操作是高考实验考查的热点,具体操作是先铺一层KClO3,然后插上镁条,最后点燃镁条引发反应进行。
(2)铝既能与酸(非氧化性酸)又能与强碱反应产生H2的性质常作为推断题的“题眼”。
2.“铝三角”的应用
(1)判断离子共存:
Al3+与OH?、S2?、HS?、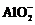 、
、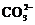 、
、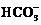 因为相互促进水解或生成沉淀而不能大量共存,
因为相互促进水解或生成沉淀而不能大量共存,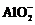 与H+、
与H+、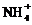 、Al3+、Fe3+等不能大量共存。
、Al3+、Fe3+等不能大量共存。
(2)物质的鉴别(利用滴加顺序不同,现象不同):
AlCl3溶液中滴加NaOH溶液现象为:先生成白色沉淀,后沉淀溶解;NaOH溶液中滴加AlCl3溶液现象为:开始生成沉淀立即溶解,后产生白色沉淀,继续滴加沉淀不溶解。
(3)Al(OH)3的制备:
①可溶性铝盐和氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3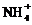 。
。
②可溶性铝盐和偏铝酸盐反应:Al3++3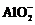 +6H2O===4Al(OH)3↓。
+6H2O===4Al(OH)3↓。
③偏铝酸盐和弱酸反应: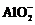 +CO2+2H2O===Al(OH)3↓+
+CO2+2H2O===Al(OH)3↓+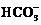
④离子反应先后顺序问题:
当溶液中有多种离子时,要考虑离子间的反应顺序,如向含有H+、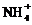 、Mg2+、Al3+的混合溶液中逐滴加入NaOH溶液,反应顺序为:H+―→Mg2+、Al3+―→
、Mg2+、Al3+的混合溶液中逐滴加入NaOH溶液,反应顺序为:H+―→Mg2+、Al3+―→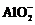 ―→Al(OH)3。
―→Al(OH)3。
3.铁、铜及其化合物的一些易误知识点也应掌握,现总结如下:
①铜在潮湿的空气中最终不是生成CuO,而是生成铜绿[Cu2(OH)2CO3]。
②常用灼热的铜粉除去N2中的O2,灼热的CuO除去CO2中的CO。
③新制Cu(OH)2悬浊液常用来检验醛基。
④Cu和一定量的浓HNO3反应,产生的是NO2和NO的混合气体,当Cu有剩余,再加入稀H2SO4,Cu继续溶解。
⑤Cu:紫红色;CuO:黑色;Cu2S:黑色;CuS:黑色;Cu2O:砖红色。
⑥Fe与O2、H2O(g)反应的产物都是Fe3O4而不是Fe2O3。Fe与Cl2反应时生成FeCl3,与S反应时生成FeS,说明Cl2的氧化能力大于S的。常温下,Fe、Al在冷的浓硫酸和浓硝酸中发生钝化,但加热后继续反应。Fe在Cl2中燃烧,无论Cl2过量还是不足均生成FeCl3。
⑦向含Fe2+的溶液中加入硝酸、KMnO4溶液、氯水等具有氧化性的物质时,溶液会出现浅绿色―→棕黄色的颜色变化,该现象可用于Fe2+的检验。
⑧制备Fe(OH)2的方法很多,原则有两点:一是溶液中的溶解氧必须提前除去;二是反应过程中必须与O2隔绝。
1.下列结论中正确的是
选项
实验1
实验2
结论
A
将SO2通入石蕊试液中
将Na2O2加入酚酞试液中
都是先变红后褪色
B
将少量CO2和H2O(g)通过足量Na2O2固体
少量NaHCO3溶液与过量Ca(OH)2溶液混合
都有Na2CO3生成
C
将Na2O2固体加入FeCl2溶液中
将NaOH溶液与Fe2(SO4)3溶液混合
最终都有红褐色沉淀生成
D
1 mol Na2O2固体与足量水反应
1 mol Fe在足量Cl2中燃烧
都是转移2 mol电子
2.如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
选项
W
X
Y
Z

A
N2
NH3
NO2
HNO3
B
Na
Na2O2
NaOH
NaCl
C
Fe
FeCl3
Fe(OH)2
FeCl2
D
Al
AlCl3
NaAlO2
Al2(SO4)3
3.球墨铸铁中含有一种铁碳化合物X。实验室测定化合物X的组成实验如下:
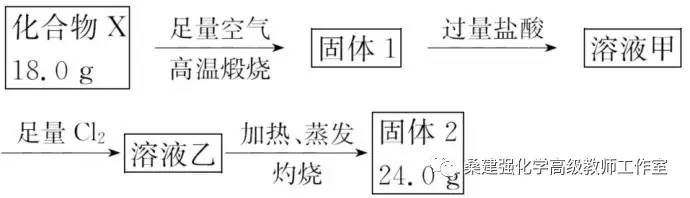
下列说法不正确的是
A.固体2是氧化铁
B.X的化学式可以表示为Fe3C2
C.溶液甲中可能含有Fe3+
D.X与足量的热浓硝酸反应有NO2和CO2生
1.【答案】C
【解析】A项,将SO2通入石蕊试液中,溶液只变红不褪色,错误。B项,将少量NaHCO3溶液与过量Ca(OH)2溶液混合,生成CaCO3、NaOH和H2O,错误。C项,Na2O2与水反应生成NaOH和O2,NaOH与FeCl2反应生成Fe(OH)2,O2将Fe(OH)2氧化为Fe(OH)3;NaOH溶液与Fe2(SO4)3溶液反应生成Fe(OH)3,正确。D项,1 mol Na2O2固体与水反应转移1 mol电子,1 mol Fe在足量Cl2中燃烧转移3 mol电子,错误。
2.【答案】D
【解析】常温下N2不能直接转化为NH3、NO2、HNO3;A项错误;常温下Na与O2反应生成Na2O而不是Na2O2,B项错误;常温下Fe不能转化为Fe(OH)2,Fe和氯气在点燃时发生反应生成FeCl3,C项错误;Al和盐酸反应转化为AlCl3,与NaOH溶液反应转化为NaAlO2,与硫酸反应转化为Al2(SO4)3,AlCl3与NaOH溶液反应转化为NaAlO2,NaAlO2与硫酸反应转化为Al2(SO4)3,Al2(SO4)3与BaCl2溶液反应转化为AlCl3,D项正确。
3.【答案】B
【解析】铁碳化合物X,在足量空气中煅烧得固体1为铁的氧化物,可以有+2价或+3价的铁,溶于盐酸所得溶液中可能有Fe2+和Fe3+,再通入足量的氯气,溶液中都为+3价的铁,加热蒸发,Fe3+水解,生成氢氧化铁,灼烧后氢氧化铁分解得固体2为氧化铁,24 g氧化铁中含有铁元素的质量为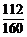 ×24 g=16.8 g,利用元素守恒,可计算得化合物X中铁元素的质量也是16.8 g,进而求得X中碳元素的质量为18.0 g?
×24 g=16.8 g,利用元素守恒,可计算得化合物X中铁元素的质量也是16.8 g,进而求得X中碳元素的质量为18.0 g?
16.8 g=1.2 g,所以在X中铁、碳原子的物质的量之比为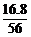 ∶
∶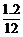 =3∶1,所以X的化学式为Fe3C,Fe3C与热的浓硝酸发生氧化还原反应,碳元素可被氧化成二氧化碳,硝酸中的氮可被还原成二氧化氮,根据上面的分析可知。固体2是氧化铁,故A正确;X的化学式可以表示为Fe3C,故B错误;溶液甲中可能含有Fe3+,故C正确;与足量的热浓硝酸反应有NO2和CO2生成,故D正确。
=3∶1,所以X的化学式为Fe3C,Fe3C与热的浓硝酸发生氧化还原反应,碳元素可被氧化成二氧化碳,硝酸中的氮可被还原成二氧化氮,根据上面的分析可知。固体2是氧化铁,故A正确;X的化学式可以表示为Fe3C,故B错误;溶液甲中可能含有Fe3+,故C正确;与足量的热浓硝酸反应有NO2和CO2生成,故D正确。
相关文章
- 什么情况会发生钝化反应 钝化是什么意思
- 高二化学||化学反应速率与化学平衡类试题的解题方法与技巧
- 高考化学:可逆反应与化学平衡状态(重点)
- 有关过氧化钠与二氧化碳、水的反应
- 离子反应与离子共存知识点总结
- 高考化学 | 化学反应速率知识汇总
- 【知识点】“化学反应速率和化学平衡”知识点归纳
- 【知识点】高考化学考点:分散系、胶体与溶液的概念及关系
- 【涨知识】化学党能活着简直不容易!10个经典的爆炸化学反应
- 【知识点】高考化学反应速率、化学平衡汇总,速来抱走!
- 高中化学:详细知识点汇总【考试通用版】
- 高考化学考点解读——常见有机物的性质和应用
- 高考化学必背67个离子方程式,你都会背了吗?
- 【收藏】高中化学全部“过量、少量”问题化学方程式总结
- 高中化学常见物质颜色归纳
- 学会三大守恒,搞定90%高考化学题!
- 高中化学:超全公式汇总【精品】
- 高考化学40个常错知识点
- 高考二轮 | 专题5 化学反应速率、化学平衡
- 化学 “一招”击毙高考化学6类易错点!
推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,