一、化学式
1. 化学式:用元素符号和数字组合来表示物质组成的式子。
2.化学式的含义:以水的化学式H2O为例
①表示一种物质:表示水这种物质
②表示这种物质的元素组成:表示水由氢元素和氧元素组成的
③表示这种物质的一个分子:表示一个水分子
④表示这种物质的一个分子的构成:表示一个水分子是由两个氢原子和一个氧原子构成的
【思考】说出符号H、2H、H2、2H2 、2H+、2H+、H2O、2H2O的意义。
3.化学式的写法与读法:
(1)单质
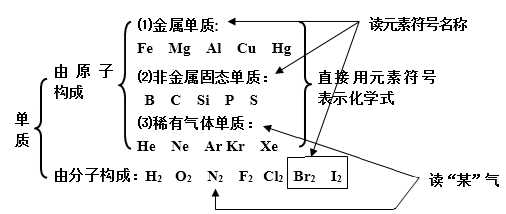
(2)化合物

(3) 含原子团的化合物的读法
①含有OH的化合物一般读作:“氢氧化某”;
②含有NO3、CO3、SO4、PO4等的化合物,一般根据原子团和另一元素的名称从右到左的顺序读作:“某酸某”。
二、化合价
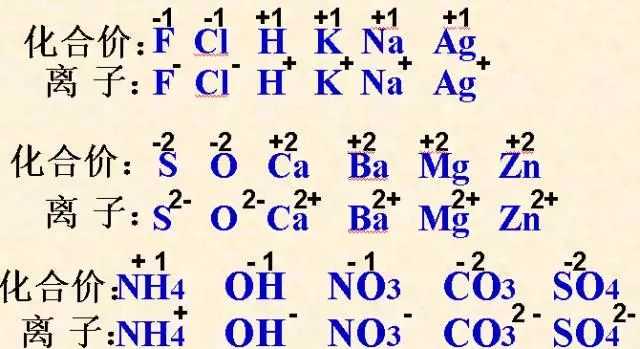
1.化合价的写法:在元素符号或原子团上方标出化合价,“+”、“-”写在前,数字写在后。
2.掌握元素的化合价,请注意掌握以下几点规律:
(1)①金属元素通常显正价,非金属元素通常显负价;
②在化合物中,通常氢显+1价;氧显-2价;③单质里元素的化合价为零;
(2)许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价。
(3)使用化合价的规则是:在化合物里,元素正负化合价的代数和为零。
(4)掌握常见原子团的化合价。原子团是在化学反应中相对稳定的原子集团,又叫做根。
3.常见元素及原子团的化合价(熟记)
化合价实质要认准 金正非负单质零
许多元素有变价 条件不同价不同
+1价钾钠氢和银 +2价钙镁钡和锌
一、二 铜汞 二、三铁 +3价金属铝和金
氟氯溴碘-1价 氧硫-2价(两元素组成的化合物中)
-1价硝酸氢氧根 -2价硫酸碳酸根
-3价的是磷酸根 +1价的是铵根
4.化合价的应用
(1)已知化合价写化学式
书写方法:正价前 负价后 化合价 标上方 先化简 后交叉
(2)已知化学式求化合价
方法:根据化合物中各元素正负化合价代数和为0进行求解。一般先标出不变价元素的化合价,后标出可变价元素。
HNO3、H3PO4、N2O5 、NH3 、HClO、 CuSO4 5H2O、
(3)由原子团的化合价,求其中某元素的化合价
方法:根据原子团化合价等于各元素正负化合价代数和进行求解。
SO42- CO32- PO43- NO3- NH4+ R2O72- HnRO4 NH4NO3
三、有关相对分子质量的计算
1. 相对分子质量(Mr):化学式中各原子的相对原子质量的总和。
2. 有关相对分子质量的计算类型
(1)计算相对分子质量
例:求O2、NH4NO3、 Al2(SO4)3、CuSO4?5H2O的相对分子质量
(2)计算物质组成元素的质量比
方法:质量比=各原子相对原子质量总和之比。
例:求CO2、H2SO4、NH4NO3中各元素的质量比
该元素的相对原子质量×原子个数×100%
(3)计算物质中某元素的质量分数

附 化合价与离子符号的书写(元素化合价的表示方法及其与离子的对应关系)







 为了学好化学,必须做一
为了学好化学,必须做一 初三化学入门就算顺利通
初三化学入门就算顺利通 提高初中化学成绩的五种
提高初中化学成绩的五种 初中生快速提高化学成绩
初中生快速提高化学成绩