化学难题巧解五招
化学习题千变万化,扑朔迷离。但只要你法眼如炬,巧用科学的思维方法来分析有关化学问题,就可以明辨概念,破解难点。在解题中独辟蹊径,化繁为简,化难为易,进而达到准确、快速解答的目的。
招数一:妙用电子守恒,拨开迷雾破陷阱。
氧化还原反应是高考必考的考点,也是中学化学学习的重点与难点。题型多变,题意迷离,令许多同学左支右绌,难以招架。其实,“你有千变万化,我有一定之规”,只要抓住了氧化还原反应的实质——电子转移,运用得失电子守恒,便可拨开迷雾,豁然开朗。
【例1】将5.6gFe投入热的浓硝酸中,产生红棕色气体A,把所得溶液减压蒸干,得到20gFe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红棕色混合气体B。将A、B气体混合后通入足量的水中,在标准状况下剩余气体的体积为( )
A. 2240mL B. 4480mL C. 3360mL D. 1120mL
【解析】粗看此题,我们会想到利用“5.6gFe”和“20gFe(NO3)2和Fe(NO3)3的混合物”来设未知数列方程求解。这样做就走进了题目设置的陷阱,且不说找关系式和计算,单是铁与硝酸反应的两个方程式及Fe(NO3)2和Fe(NO3)3分解的两个方程式就够有些同学忙一阵的了。这样就犯了做选择题的大忌——小题大做。如果我们抓住得失电子守恒,先找出以下关系:

首先,我们来分析一下最后剩余的气体可不可能是O2。Fe最终变成Fe2O3失去电子,若剩余的气体是O2,则O的化合价从-2价升到0价,也失去电子,不可能。所以剩余的气体只能是NO。
从上述关系图中不难看出,Fe失去的电子总数等于N得到的电子总数。所以,剩余的NO气体的物质的量为0.1mol,即2240mL。
【答案】(A)
【例2】已知:11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4,反应中1molCu2+能氧化P的物质的量为( )
A.![]() mol B.
mol B. ![]() mol
C.
mol
C. ![]() mol
D.
mol
D. ![]() mol
mol
【解析】本题常犯的错误为选A或B,选B的同学片面地认为CuSO4是氧化剂,P是还原剂,故用CuSO4、P的系数列比例求解;而选A的同学虽然注意到了11 mol P中只有6 mol生成H3PO4被氧化,却忽略了P歧化时本身的电子转移。
但如果撇开P歧化时本身的电子转移,追踪Cu2+与P之间的电子得失,设被Cu2+氧化的P为x mol,则:Cu2+得电子总数= P(部分)失电子数,而有:1×1 = 5x,解得x= ![]()
【答案】(C)
演练一:
1、若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
A.1:4 B. 1:2 C. 2:1 D. 4:1
2、某温度下,将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量浓度之比是1:2,则Cl2与KOH反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为( )
A、2:3 B、4:3 C、10:3 D、11:3
3、某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是( )
A、NO2 B、NO C、N2O D、N2
4、用两支惰性电极插入500mLAgNO3溶液中,通电电解,当电解液的PH从6.0变为3.0时(设电解时阴极没有H2析出,且电解前后溶液体积不变),电极上应析出银的质量是( )
A、27mg B、54mg C、108mg D、216mg
5、用惰性电极电解M(NO3)×的水溶液,当阴极上增重ag时,在阳极上同时产生bL氧气(标准状况),从而可知M的相对原子质量为( )
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
【参考答案】
1、B 2、D 3、C 4、B 5、C
招数二:巧用元素守恒,出奇制胜解疑难。
化学反应的实质是旧化学键的断裂和新化学键的形成过程,一切化学反应均不过是原子间的重新组合,原子的种类和数目并没有改变,因而反应前后某元素物质的量也不变。在解题过程中,巧妙地利用这一守恒关系,追踪元素,常可出奇制胜。
【例3】取一定量的Na2CO3、NaHCO3和Na2SO4固体的混合物与250mL 1.00mol·L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol·L-1Ba(OH)2溶液,得到沉淀的质量为2.33 g,溶液中过量的碱用10.0mL 1.00mol·L-1盐酸恰好完全中和。计算混合物中各物质的质量。
【解析】本题涉及的反应方程式有四个:Na2CO3+2HCl==2NaCl+H2O+CO2↑;NaHCO3+HCl==NaCl+H2O+CO2↑;SO42-+Ba2+==BaSO4↓;H++OH-==H2O。按常规思路需分步进行计算,非常繁琐。而运用元素守恒关系则可不必写方程式而快速作答:
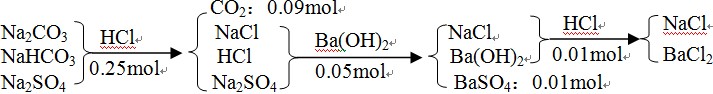
① 据硫元素守恒:n(Na2SO4)= n(BaSO4)=0.01mol
②根据钡元素守恒:n(BaCl2)= n(Ba(OH)2)- n(BaSO4)= 0.05mol-0.01mol=0.04mol
③设Na2CO3和NaHCO3的物质的量分别为x、y
根据钠元素守恒:n(NaCl)=2n(Na2CO3)+n(NaHCO3)+2n(Na2SO4)
根据氯元素守恒又有:n(NaCl)+2n(BaCl2)=n(HCl)
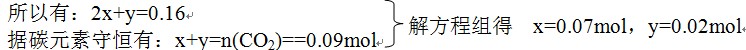
据碳元素守恒有:x+y=n(CO2)==0.09mol
所以,Na2CO3、NaHCO3的质量分别为0.07mol×106g·mol-1=7.42g、0.02mol×84 g·mol-1=1.68g。
【答案】Na2SO4的质量为1.42g。Na2CO3、NaHCO3的质量分别为7.42g和1.68g。
【例4】有一在空气中放置了一段时间的KOH固体,经分析测知其含水2.8%、含K2CO337.3%。取1克该样品投入25毫升2 mol ·L-1的盐酸中后,多余的盐酸用1.0 mol ·L-1KOH溶液30.8mL恰好完全中和,蒸发中和后的溶液可得到固体( )
(A)1g (B)3.725 g (C)0.797 g (D)2.836 g
【解析】KOH、K2CO3跟盐酸反应的主要产物都是KCl,最后得到的固体物质是KCl,根据元素守恒,盐酸中含氯的量和氯化钾中含氯的量相等:n(KCl)=n(Cl-)=n(HCl)。
【答案】B
演练二:
1. 由氧化铜、氧化铁、氧化锌组成的混合物ag,加入2 mol ·L-1的硫酸溶液50ml时固体恰好完全溶解。若将该混合物在足量的一氧化碳中加热充分反应,冷却后剩余固体的质量为 ( )
A.1.6g B.(a-1.6)g C.(a-3.2)g D.无法计算
2.用1L 1.0mol·L-1NaOH溶液吸收0.8molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比约是( )
A、1:3 B、2:1 C、2:3 D、3:2
3.在CO和CO2的混合气体中,氧元素的质量分数为64%。将该混合气体5g通过足量的灼热氧化铜,充分反应后,气体再全部通入足量的澄清石灰水中,得到的白色沉淀的质量是( )
A、5克 B、10克 C、15克 D、20克
4.碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,消耗1mol·L-1盐酸500mL。燃烧等质量的上述混合物,得到氧化铜的质量是( )
A、35g B、30 g C、20 g D、15 g
5.把7.8gNa2O2和7.9gNH4HCO3装入密闭容器中加热至150℃,充分反应后排出气体,冷却至常温,取出全部残留固体,加水溶解并定容至250mL,求所得溶液中Na2CO3物质的量的浓度。( )
【参考答案】
1、B 2、A 3、C 4、C 5、0.4mol·L-1。
招数三:活用电荷守恒,拔刀亮剑斩乱麻。
在解剖有关离子反应的习题时,电荷守恒是一把锋利的刀。有了这把刀,就不必纠缠于纷纭繁杂的离子反应的一团乱麻中,只需关注始态与终态之间离子的电荷平衡关系,从而快刀斩乱麻,大大加快了解题进程。
【例5】向100mL 0.5mol·L-1的Na2CO3溶液中逐滴加入100mL某浓度的硫酸溶液(边滴边振荡),充分反应后,向混合溶液中加入6.24gBaCl2固体,恰好使溶液的-2价阴离子沉淀完全。则所加硫酸溶液的物质的量浓度可能为 ( )
A. 0.35mol·L-1 B. 0.2mol·L-1 C. 0.15mol·L-1 D. 0.1mol·L-1
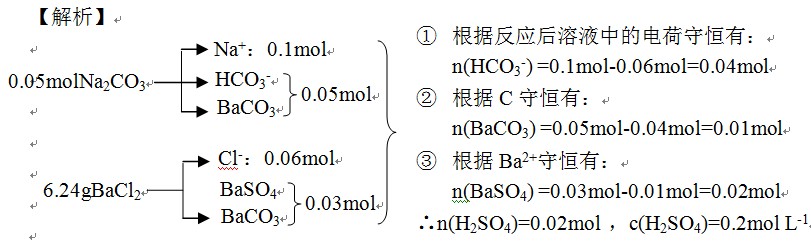
【答案】B
【例6】76.8mg铜和10mL 6mol·L-1硝酸反应,铜全部溶解后,如果NO3-离子减少0.2mol·L-1,则溶液中H+同时下降( ),设反应前后溶液体积的变化可忽略不计。
A.0.22mol·L-1 B.0.32mol·L-1 C.0.44mol·L-1 D.0.4mol·L-1
【解析】本题若用常规解题法,需先判断硝酸的还原产物——NO、NO2或其混合物,再列出两个方程式联立求解。步骤繁杂,未免小题大做。采用电荷守恒则事半功倍:
H+下降的浓度==NO3-离子减少的浓度 + 被Cu2+离子替换的H+的浓度
==NO3-离子减少的浓度 + 2×Cu2+的浓度
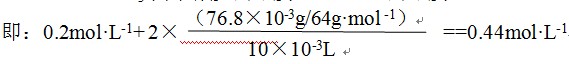
【答案】C
演练三:
1、将 CaCl2和 CaBr2的混合物 13.400 g溶于水配成 500.00 mL 溶液,再通入过量的Cl2,完全反应后将溶液蒸干,得到干燥固体11.175g。则原溶液中,c(Ca2+)∶c(Cl-)∶c(Br-)为( )
A.3∶2∶1 B.1∶2∶3 C.1∶3∶2 D.2∶3∶1
2、含有Xn+离子的溶液10mL,浓度为1.2mol·L-1,正好使30mL0.4mol·L-1的CO32-全部沉淀,则n值为( )
A. 3 B.2 C.1 D.无法确定
3、今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验(已知:NH4++OH-![]() NH3·H2O):
NH3·H2O):
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
4、已知某H2SO4、FeSO4、Fe2(SO4)3混合溶液100 mL,其中阳离子浓度相等,SO42-浓度为6 mol / L,此溶液中还可溶解铁粉的质量为 ( )
A. 11.2 g B.16.8 g C. 33.6 g D. 5.6 g
5、镁带在空气中燃烧的全部产物(MgO、Mg3N2)溶解在100mL,2.2 mol·L-1的盐酸中,再以50mL 0.6 mol·L-1的NaOH溶液中和多余的HCl,然后在此溶液中加入过量的NaOH把NH3蒸出,并用足量盐酸吸收,测得NH3的质量为0.51g,则镁带的质量为( )
A.2.28g
B.0.96g C.1.92g
D.3.2g
【参考答案】
1、D 2、B 3、A
4、根据电中性原理,可得:c(H+)+2c(Fe2+)+3c(Fe3+)=2c(SO42-)。又由于c(H+)=c(Fe2+)=c(Fe3+),则6 c(H+)=2c(SO42-)=2×6,c(H+)=2 mol·L-1。H+溶解铁粉的质量为: 2 mol·L-1×0.1 L×0.5×56 g·mol -1=5.6 g。Fe3+溶解铁粉的质量为: 2 mol·L-1×0.1 L×0.5×56 g·mol -1=5.6 g。答案A。
5、据电荷平衡:n(Na+)+n(NH4+)+2n(Mg2+)=n(Cl-),求得镁带质量为1.92g,答案C。
招数四:智用整体思维,纵观全局巧切入。
整体思维,就是不纠缠细枝末节,纵观全局,从整体上理顺各物质之间的关系,综合处理。从而迅速找到解题切入点,达到复杂问题简单化处理的目的。
【例7】将1.92g Cu 投入到一定量的浓 HNO3 中,Cu 完全溶解,生成的气体越来越浅,共收集到标准状况下672mL气体。将盛此气体的容器倒扣在水中,求通入多少毫升标准状况下的氧气可使容器中充满液体。
【解析】按一般解法解此题较为复杂。如果抛开细节,注意到它们间的反应都是氧化还原反应,把氧化剂和还原剂得失电子相等作为整体考虑,则可化繁为简。浓
HNO3 将
Cu氧化后自身被还原为低价氮的氧化物,而低价氮的氧化物又恰好被通入的氧气氧化,最后变成
HNO3 ,相当于在整个过程中HNO3的化合价未变,即1 .92 g Cu相当于被通入的氧气氧化。由电子得失守恒知:![]() =
=
![]() , 解得,V(O2 )=0.336L ,即通入336mLO2即可。
, 解得,V(O2 )=0.336L ,即通入336mLO2即可。
【答案】336mL
【例8】有5.1g镁、铝合金,投入500mL 2 mol·L-1盐酸溶液中,金属完全溶解后,再加入4 mol·L-1NaOH溶液,若要达到最大量的沉淀物质,加入的NaOH溶液的体积为多少?( )
A.300 mL B.250 mL C.200 mL D.100 mL
【解析】物质之间的转化为:
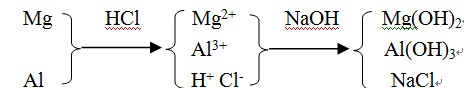
从反应的整体来观察,原溶液里的Cl- 和加入的Na+都不参加反应,最终生成NaCl,即:n(HCl)=n( NaOH)。V( NaOH)=![]()
【答案】B
演练四:
1、将NO2、NH3、O2的混合气体22.4L(标况)通过浓H2SO4后,溶液质量增加了26.7g,气体体积缩小为4.48L(标况),剩余气体使带火星的木条着火,则混合气体的平均相对分子质量为( )。
A、28.1 B、30.2 C、33.1 D、 34.0
2、向一定量Fe、FeO和Fe2O3的混合物中加入120mL 4mol·L-1的稀硝酸恰好使混合物完全溶解,放出1.344L(标准状况)气体,往所得溶液中加入KSCN溶液,无血红色出现,若用足量的氢气在加热条件下还原相同质量的混合物,能得到铁的物质的量为( )
A、0.21mol B、0.14mol C、0.16mol D、0.24mol
3、某种由K2S和Al2S3组成的混合物中,这两种组分的物质的量之比为3:2,则含32g硫元素的这种混合物的质量是( )
A.64g B.94g C.70g D.140g
4、一定量的无水乙醇完全燃烧时放出的热量为Q,它所产生的CO2用饱和石灰水吸收可得到100gCaCO3沉淀。则完全燃烧1mol无水乙醇放出的热量为( )
A、0.5Q B、Q C、2Q D、5Q
5、向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol·L-1氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是( )
A.![]() B.
B.![]() C.n=m+17Vc D.
C.n=m+17Vc D. ![]() <p<
<p<![]()
【参考答案】
1、C (提示:混合气通入浓H2SO4发生的反应有: 4 NO2+2H2O+ O2=4HNO3,2NH3+ H2SO4=(NH4)2 SO4,溶液增重的量与剩余氧气的质量和就是混合气体的质量)
2、A
(提示:溶液中n[Fe(NO3)2]=![]() (n(HNO3)- n(NO))
(n(HNO3)- n(NO))
3、C (提示:将混合物看作一个整体,其化学式为K6Al4S9)
4、C (提示:1molC~1molCO2~1mol CaCO3~Q;1 molC2H5OH中含2 molC。所以放出的热量为2Q)
5、C
招数五:借用数学思想,化繁为简找极值。
借用数学中的极限思想,把研究的对象构造为问题的两个极端,然后 “抓两端,定中间”。运用此法解题的优点是将某些复杂的、难于分析清楚的化学问题(如某些混合物的计算、平行反应计算和讨论型计算等)变得单一化、极端化和简单化,使解题过程简洁,解题思路清晰,把问题化繁为简,化难为易,从而提高了解题效率。
【例9】某混合物含有KCl、NaCl和Na2CO3,经分析含钠31.5%,含氯27.08%(以上均为质量分数),则混合物中Na2CO3的质量分数为( )
(A)25% (B)50% (C)80% (D)无法确定
【解析】 若混合物质量为100g,则可求出n (Cl-)= 0.763mol ,①假设这0.763mol的Cl-全部来自于KCl(即混合物为KCl和Na2CO3)则m(KCl)=56.84g,②假设这0.763mol的Cl-全部来自于NaCl(即混合物为NaCl和Na2CO3)则m(NaCl)=44.63g,因Cl-来自于NaCl、KCl两种物质,由平均值原理知(1-56.84%)<m(Na2CO3) %<(1-44.63%)
【答案】B
【例10】在恒温时,某容积为VL的密闭容器中通入2molX和1molY气体,发生如下反应:2X(g)+Y(g)![]() 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.2。若与上述平衡保持同温、同压,在同一密闭容器中充入a mol X和b mol
Y气体,平衡时Z的体积分数仍为0.2。则
2Z(g),压强一定时,测得在平衡时Z的体积分数为0.2。若与上述平衡保持同温、同压,在同一密闭容器中充入a mol X和b mol
Y气体,平衡时Z的体积分数仍为0.2。则![]() 的取值范围为 。
的取值范围为 。
【解析】设平衡时气体混合物中Z的物质的量为2mol,依题意平衡混合物中X和Y气体共8mol;根据化学方程式可知,已反应的X为2mol,Y为1mol。假设一:平衡时气体混合物中没有X气体,则![]() =
=![]() =
=![]() ;假设二:平衡时气体混合物中没有Y气体,则
;假设二:平衡时气体混合物中没有Y气体,则![]() =
=![]() =10。因为反应是可逆的,所以
=10。因为反应是可逆的,所以![]() <
<![]() <10。
<10。
【答案】![]() <
<![]() <10
<10
演练五:
1、在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.5 mol·L-1的HCl溶液中和,则钠与氧气反应的生成物成分是( )
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
2、含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是( )
A、Na2S B、NaHS C、Na2S和NaHS D、NaOH和NaHS
3、在密闭容器中充入等物质的量的A和B发生如下反应:A(g)+2B(g)![]() 2C(g),反应达到平衡时混合气体中A和B的物质的量之和与C的物质的量相等,则A的转化率为( )
2C(g),反应达到平衡时混合气体中A和B的物质的量之和与C的物质的量相等,则A的转化率为( )
A、40% B、50% C、60% D、70%
4、0.03mol Cu完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol 。该混合气体的平均相对分子质量可能是( )
A、30 B、46 C、56 D、66
5、某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液。若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的判断正确的是( )
A、肯定有KNO3和Na2CO3,没有Ba(NO3)2
B、肯定有KNO3,没有Ba(NO3)2,还可能有Na2CO3
C、肯定没有Na2CO3和 Ba(NO3)2,可能有KNO3
D、无法判断
【参考答案】
1、C 2、A 3、A 4、B 5、B
相关文章
- 初中化学溶液知识题型
- 初中化学:你走进”酸碱盐认识的误区“了吗?十大误区让你掉进
- 终于整理好了!中考化学要点必备!
- 初中化学相关计算公式、解题方法、步骤、例题
- 期末备考初中化学中常考物质颜色大总结,赶紧收着!
- 初中化学全册重点知识讲解
- 初中化学知识整理
- 化学老师倾情整理的离子共存问题
- 初中化学知识大全
- 初三化学酸、碱、盐九大知识点
- 中学化学备考:离子共存的判断方法
- 9个秘招攻下初中化学溶解度曲线
- 中考化学必考这些知识点,考前再复习一遍!
- 化学:铜怎么看起来这么安逸?
- 中考化学文字表述题模板 答题可以直接套用
- 初中中考化学复习总结:重要离子的检验
- 初中所有化学方程式都在这里了,赶紧收藏!(修订版)
- 2017年中考化学复习专题
- 初中化学溶液知识点、考点和往年真题
推荐内容
教育新鲜事
 为了学好化学,必须做一
为了学好化学,必须做一 初三化学入门就算顺利通
初三化学入门就算顺利通 提高初中化学成绩的五种
提高初中化学成绩的五种 初中生快速提高化学成绩
初中生快速提高化学成绩