3.27高考化学你知道多少:非金属及其化合物六大基础知识1
一、硅及其化合物的特性及应用
1.硅及其化合物性质的“十大反常”。
(1)碳族元素的主要化合价一般是+2、+4价,而硅元素常见的化合价是+4价且自然界中没有游
离态的硅。
(2)硅单质的还原性比碳单质强,而碳单质在高温下却能从SiO2中还原出Si单质。
(3)非金属单质与强碱溶液反应一般不生成H2,而硅与强碱溶液反应时却产生H2。
(4)非金属单质一般不与非氧化性酸反应,而硅不但能与氢氟酸反应且还生成氢气,即Si+4HF
==SiF4↑+2H2↑(类似于较活泼金属与酸的置换反应)。
(5)SiO2是H2SiO3的酸酐,但它不溶于水,SiO2不能直接与水作用制备H2SiO3。
(6)非金属氧化物的熔、沸点一般较低,但SiO2的熔、沸点却很高。
(7)酸性氧化物一般不与酸反应,但SiO2却能与氢氟酸发生反应SiO2+4HF==SiF4↑+2H2O。
(8)无机酸一般易溶于水,而H2SiO3却难溶于水。
(9)因为H2CO3的酸性强于H2SiO3,所以向Na2SiO3溶液中通入CO2时,能发生反应Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3。但在高温下,反应Na2CO3 + SiO2=高温=Na2SiO3+ CO2↑也能发生。
(10)Na2SiO3液俗称泡花碱,但它却是一种水溶性硅酸盐,并不是碱;Na2SiO3的水溶液俗称水玻璃,但它与玻璃的成分并不相同。
例题1:下列物质在一定条件下能与SiO2反应的有( )。
① 氢氟酸 ② 浓硫酸 ③ 烧碱溶液 ④Na2CO3固体⑤氧化钙⑥浓硝酸
A.①② ⑥ B.② ③⑥
C.① ③④⑤ D.全部
答案:C
解析:SiO2可与烧碱溶液、氧化钙、氢氟酸反应;在制玻璃的过程中,SiO2与Na2CO3固体在高温下反应。
2.硅的制备。
由硅的氧化物可以制取硅单质,主要涉及两个步骤:
(1)粗硅的制取。涉及的反应为SiO (石英砂) +2C(焦炭)=高温电炉= Si(粗硅)+2CO。
(2)由粗硅制纯硅(常用方法)。涉及的反应为Si(粗)+ 2Cl2 =△=SiCl4 ;SiCl4 + 2H2=高温=Si(纯硅)+4HCl。
例题2:下图是利用二氧化硅制备硅及其化合物的流程示意图,下列说法正确的是( )。
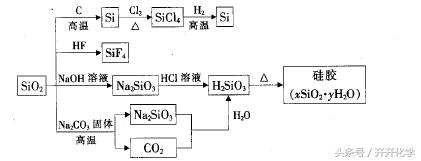
A.SiO2属于两性氧化物
B.盛放Na2CO3溶液的试剂瓶用玻璃塞密封
C.硅胶吸水后可重复再生
D.图中所示的转化都是氧化还原反应
答案:C
解析:SiO2是酸性氧化物,Na2CO3溶液呈碱性,盛放用的试剂瓶不能用玻璃塞密封,途中SiO2与NaOH溶液的反应不是氧化还原反应。
二、氯气的性质和制法
1.氯气的性质。
(1)与金属单质反应,能将变价金属氧化成高价金属氯化物。
① 与铁反应:2Fe+3Cl=点燃=2FeCl3。
② 与铜反应:Cu+Cl2=点燃=CuCl2。
(2)与非金属单质反应。如与H2发生反应H2+ Cl2=点燃=2HCl。
(3)与水反应。溶于水的氯气部分与水发生反应Cl2+ H2O=可逆符号=HCl+HClO。
(4)与碱液反应。如与NaOH 溶液发生反应Cl2+2NaOH==NaCl+NaClO+ H2O。
(5)与还原性化合物反应。
① 与碘化钾溶液反应:2KI+Cl2 ==I2 +2KCl
② 与SO2 的水溶液反应:Cl2 + SO2 + 2H2O==H2SO3 + 2HCl。
③ 与FeCl2溶液反应:2FeCl2+Cl2==2FeCl3。
2.氯气的实验室制法。
(1)制备流程(实验装置如下图所示)。
① 反应原理:用强氧化剂(如MnO2、KC1O3、KMnO4等)氧化浓盐酸,如反应MnO2 +4HCl(浓) =△=MnCl2+Cl2 ↑+2H2O(或2KMnO4+16HCl(浓)==2KCl+2MnCl2 + 5Cl ↑+ 8H2O)。
② 制备装置类型:固体+液体 堕型 气体。
③净化方法:通过盛有饱和食盐水的洗气瓶除去Cl2中混有的HCl气体,再通过盛有浓硫酸的洗气瓶除去Cl2中混有的水蒸气。
④ 收集气体:用向上排空气法或排饱和食盐水法。
⑤尾气吸收:用强碱溶液(如NaOH 溶液)吸收。
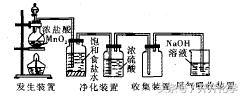
(2)验满。把湿润的淀粉碘化钾试纸(或湿润的蓝色石蕊试纸)靠近集气瓶口,若试纸变蓝(或先变红后褪色),则证明已集满。
(3)注意事项。
①必须用浓盐酸,因为稀盐酸不反应。
② 为减少浓盐酸的挥发,加热温度不宜过高。
③实验结束后,先等反应结束并吸收完残留的Cl2再拆卸装置,以免污染空气。
例题3:下图是某同学设计的以二氧化锰和浓盐酸为主要原料制备氯气的实验装置(其中A是连有注射器针头的橡胶管,针头已插入并穿过橡胶塞)。试回答下列问题:
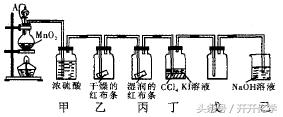
(1)实验时,乙中的现象是______,丙中的现象是______,丁中的现象是______ ;分离丁中液体所需的实验操作是 ______。
(2)橡胶塞连通后,分液漏斗中气体的压强p1与烧瓶中气体的压强 p2的关系为:p1____p2(填“>”“<”或“一”),连接橡胶管的目的是 ____________。
(3)烧瓶内发生反应的离子方程式为________________________。
答案:(1)干燥的红布条不褪色 湿润的红布条褪色 下层CCl4层呈紫红色 用分液漏斗分液
(2)= 有利于分液漏斗里的浓盐酸顺利流人烧瓶中
(3)MnO2+4H+ +2Cl- =△= Mn2+ + CI2↑+2H2O
解析:利用发生装置制备Cl2后,通过浓硫酸将Cl2干燥(甲中)Cl2不能使干燥的红布条褪色(乙中)Cl2与H2O(湿润的红布条中含有H2O)反应生成的HCIO起漂白作用,使红布条褪色(丙中),CI2与KI溶液反应生成I2,CCl4 萃取I2,溶液分层(丁中),用向上排空气法收集Cl2(戊中);用NaOH 溶液进行尾气吸收(己中)。分液漏斗与烧瓶间用橡胶管连接后,分液漏斗与烧瓶内的气压相等,有利于液体顺利流下。
三、次氯酸和漂白粉的性质
1.次氯酸。
(1)具有不稳定性。见光易分解,发生反应:2HCIO=光照=2HCl+O2↑。氯水须现用现配,保存在棕色试剂瓶中并置于冷暗处。
(2)具有强氧化性。① 作漂白剂,能使某些染料和有机色素褪色。②用于杀菌、消毒。
(3)具有弱酸性。往NaClO溶液中通人少量CO2,发生反应2NaClO+CO2+H2O==Na2CO3+2HClO。
2.漂白粉。
(1)成分。主要成分为CaC1 、Ca(ClO)2。有效成分为Ca(ClO)2。
(2)制取原理。Cl2与Ca(OH) 2溶液发生反应2CI2+ 2Ca(OH)2==CaCl2+ Ca(CIO)2+ 2H2O。
(3)化学性质。水解呈碱性,具有强氧化性。
(4)失效的原因。Ca(CIO)2易与空气中的H2O(g)、CO2发生反应Ca(CIO)2+ H2O+CO2=CaCO3↓+2HCIO,生成的HClO易分解。
例题4:下列关于漂白粉的叙述正确的是( )。
A.漂白粉的有效成分是Ca(ClO) 2和CaCl2
B.漂白粉在空气中久置后会变质
C.漂白粉是由Cl2与烧碱反应制得的
D.在使用漂白粉时,加入浓盐酸会加强漂白效果
答案:B
解析:漂白粉的有效成分为Ca(ClO)2;漂白粉的制法为将Cl2通入石灰乳中,两者发生反应;漂白粉可作为漂白剂,用于杀菌、消毒,漂白原理是在水中或与酸作用时生成HClO,HClO有漂白、杀菌的作用;漂白粉久置会变质,与空气中的CO2、H2O(g)反应,生成易分解的HCIO;在使用漂白粉时加入浓盐酸,漂白效果反而不好,因为Ca(ClO)2 有强氧化性,会将Cl-氧化,发生反应Ca(ClO)2+4HCl(浓)==CaCl2+2Cl2↑+2H2O。

推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,