高考化学考点解读——有关阿伏加德罗常数的综合判断
高考频度:★★★★★ 难易程度:★★★☆☆
NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,4.4 g体积比为3∶1的CO2和N2O组成的混合气体中所含原子总数为0.3NA
B.CH4与P4的分子结构均为正四面体形,在1 mol CH4分子或P4分子中含有的共价键数皆为4NA
C.含有NA个阴离子的Na2O溶于1 L水中,所得溶液中溶质的物质的量浓度为1 mol·L-1
D.1 mol Na被完全氧化生成Na2O2,失去2NA个电子
【参考答案】A
【试题解析】由于CO2和N2O的摩尔质量相同,而且一个分子中含有的原子个数也相同,所以0.1 mol混合气体中含有的原子总数为0.3NA,A项正确;1 mol P4分子中含有的P—P键为6NA,B项错误;由于Na2O溶于1 L水后,溶液体积改变,无法求算物质的量浓度,C项错误;1 mol Na被氧化转移的电子数应为NA,D项错误。答案选A。
阿伏加德罗常数常见考查的知识方向与速判技能
知识方向
速判技能
气体体积
没有指明温度、压强的气体体积,其数值无实际意义
22.4 L/mol
的使用
①看是否为标准状况;
②标准状况下对应物质是否为气体
可逆过程
①盐的水解、弱电解质的电离是可逆的;
②Cl2与H2O、N2与H2、SO2与O2、酯化反应等均是可逆反应,反应物不可能消耗完
反应进程中
止或方向的
改变
①浓盐酸与MnO2、浓硫酸与金属活动性顺序中氢后边的金属反应,酸不可能消耗完;
②浓硝酸与足量金属(NO2→NO)、过量铁与硝酸(Fe3+→Fe2+)、浓硫酸与金属活动性顺序中氢前边的金属反应(SO2→H2)
组成与结构
①稀有气体为单原子分子、离子化合物中无分子,“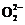 ”是一个阴离子;
”是一个阴离子;
②金刚石、晶体硅、SiO2中每个碳原子、硅原子形成四个键,石墨中每个碳原子形成三个键(1 mol上述物质中存在的共价键分别为2NA、2NA、4NA、1.5NA);
③苯中没有“C=C”,一个丙烯酸(CH2=CHCOOH)分子中有两个双键
电子转移
数目
抓住计算所依据的物质在反应中组成元素的价态变化,并要考虑反应是否存在可逆性、进行过程中反应的中止或方向改变的情况
胶粒组成与
隐含反应
①一个氢氧化铁胶粒含若干个Fe(OH)3微粒;
②2NO2  N2O4
N2O4
考查思维的
灵活性(已
知条件为总
质量一定的
含有A、B两
种物质的混
合物)
类型
①看物质的最简式是否相同(如乙烯与丙烯);
②看物质的相对分子质量是否相同(如N2、CO);
③看A、B是否由同一种元素组成(如O2、O3);
④看A、B中相同元素的质量分数是否相同(如CuO、Cu2S)。
对策
分析时可将①、②中A、B物质视为组成最简单的那一种物质,由该物质组成求某种原子数目或原子总数目;③可将混合物直接看作是由对应原子构成的;④可直接求出相同元素的质量
1.设阿伏加德罗常数为NA,下列说法正确的是
A.3.0 g淀粉和葡萄糖混合物中共含碳原子数为0.1 NA
B.2.9 g 2CaSO4·H2O含有的结晶水分子数为0.02 NA(2CaSO4·H2O式量为290)
C.在100 g 98%的浓硫酸中含氧原子个数不等于4NA
D.1 L、0.1 mol/L氨水中NH3·H2O的个数为0.1NA
2.设阿伏加德罗常数为NA,下列说法正确的是
A.1mol OH-在电解过程中被氧化时,提供电子的数目为NA个
B.用惰性电极电解NaCl溶液,每生成a g NaOH时,电路中通过的电子数为aNA
C.铜的电解精炼时,每转移2 mol电子阳极上溶解的铜原子数等于NA
D.用粗铜作阳极电解稀硫酸,当生成0.1mol H2时,阳极失去的电子数为0.2NA
3.设阿伏加德罗常数为NA,下列说法正确的是
A.含2NA共价键的CnH2n+2分子中的物质的量为 mol
mol
B.6.0 g乙醛分子中共用电子对的数目为0.6NA
C.乙炔完全燃烧时,有8NA碳氧共用电子对生成,则转移5NA电子
D.若乙炔的燃烧热为Q kJ·mol?1,若一定量的乙炔燃烧放热为Q kJ,则断键为5NA
1.【答案】C
【解析】A中,淀粉的分子式为(C6H10O5)n,而葡萄糖的分子式为C6H12O6,两者的最简式很容易混淆,则A错。B中,1 mol熟石膏中含有2 mol CaSO4和1 mol H2O,则0.01mol熟石膏中含有0.01mol水分子,B错。C中,H2SO4为98 g,1 mol,4NA氧原子,注意水中还有氧原子,则C正确。D中氨水中含氮的微粒除NH3·H2O外,还含有NH3和NH4+,这三者合起来为0.1NA,D错。综合上述,选C。
【归纳总结】常见特殊组成有如下几种情况:①有些物质最简式相同,如乙烯、丙烯等单烯烃、葡萄糖与果糖、淀粉与纤维素等、饱和一元羧酸与饱和一元酯等。②有些物质中某元素的百分含量相等,如Cu2S和CuO中Cu,甲苯与甘油中的氢、CaCO3、KHCO3中的碳等。③有些物质中阴阳离子个数的比值易混淆,BaO2中Ba2+与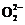 之比为1︰1,Na2O2中Na+与
之比为1︰1,Na2O2中Na+与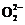 为2︰1。④计算溶液中氢、氧原子个数时,应算溶液中水的氢、氧原子。
为2︰1。④计算溶液中氢、氧原子个数时,应算溶液中水的氢、氧原子。
2.【答案】D
【解析】A中,根据阳极反应式:4OH? ? 4e-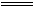 O2↑+2H2O,4 mol OH?在电解过程中只有2 mol被氧化,提供4NA电子,因此A错。B中,根据阴极反应式:2H2O+2e-
O2↑+2H2O,4 mol OH?在电解过程中只有2 mol被氧化,提供4NA电子,因此A错。B中,根据阴极反应式:2H2O+2e- 2OH?+H2↑,生成a g NaOH时,转移的电子数为:
2OH?+H2↑,生成a g NaOH时,转移的电子数为: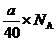 ,则B错。C中,在铜电解精练时,阳极上不仅铜失去电子,比铜活泼的金属如锌、铁,也失去电子,则C错。D中,阴极反应式为:2H++2e-
,则B错。C中,在铜电解精练时,阳极上不仅铜失去电子,比铜活泼的金属如锌、铁,也失去电子,则C错。D中,阴极反应式为:2H++2e- H2↑,根据电子得失相等,当阴极生成0.1 mol H2时,则得到0.2 mol电子,阳极失去的电子数为0.2 NA电子。综合上述,选D。
H2↑,根据电子得失相等,当阴极生成0.1 mol H2时,则得到0.2 mol电子,阳极失去的电子数为0.2 NA电子。综合上述,选D。
【归纳总结】解电化学的题目,首先在于运用电子得失守恒、质量守恒、电荷守恒,正确写出电极式,然后根据电极反应式来判断;其次对氯碱工业、铜的电解精练等工业流程要非常熟悉。
3.【答案】A
【解析】A中,烷烃CnH2n+2中,化学键为碳碳键和碳氢键,每个氢原子只成一根碳氢键,因此有多少个氢就有多少碳氢共用电子对,则碳氢共用电子对为2n+2。每两个碳之间成一个碳碳键,故n个碳原子之间形成n-1根碳碳键,则1mol烷烃CnH2n+2中化学键的总数为(3n+1)NA;反之,含2NA共价键的CnH2n+2分子中的物质的量为 mol,则A对。B中,先写出乙醛的结构式,得出1 mol乙醛中有7 mol共用电子对,则6.0 g乙醛分子中共用电子对的数目为:
mol,则A对。B中,先写出乙醛的结构式,得出1 mol乙醛中有7 mol共用电子对,则6.0 g乙醛分子中共用电子对的数目为: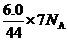 ,则B错。C中,乙炔中碳为?1价,燃烧后生成二氧化碳时,碳为+4价,则1mol乙炔完全燃烧,生成2 mol二氧化碳,转移电子数为10 mol,而1 mol二氧化碳中有4 mol碳氧键,所以有8NA碳氧键生成,则C错。D中,1mol乙炔完全燃烧时,除了断1 mol乙炔中的5 mol键外,还断氧气中的氧氧键,则D错。
,则B错。C中,乙炔中碳为?1价,燃烧后生成二氧化碳时,碳为+4价,则1mol乙炔完全燃烧,生成2 mol二氧化碳,转移电子数为10 mol,而1 mol二氧化碳中有4 mol碳氧键,所以有8NA碳氧键生成,则C错。D中,1mol乙炔完全燃烧时,除了断1 mol乙炔中的5 mol键外,还断氧气中的氧氧键,则D错。
推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,