高考化学 | 专题7 原电池、电解池及其应用
1.要有活动性不同的两个电极(一种金属与另一种金属或石墨或不溶性的金属氧化物);
2.要有电解质溶液;
3.两电极浸入电解质溶液且用导线连接或直接接触。
1.确定原电池电极名称的方法
方法一:根据电极材料的性质确定。通常是
(1)对于金属——金属电极,活泼金属是负极,不活泼金属是正极;
(2)对于金属——非金属电极,金属是负极,非金属是正极,如干电池等;
(3)对于金属——化合物电极,金属是负极,化合物是正极。
方法二:根据电极反应的本身确定。
失电子的反应→氧化反应→负极;得电子的反应→还原反应→正极。
2.确定电解(镀)池电极名称的方法
方法一:与外电源正极连接的一极是阳极、与负极连接的一极是阴极。
方法二:电极上发生氧化反应的是阳极,发生还原反应的是阴极。
1.可设计成原电池的反应一般应满足如下条件:
(1)反应放热;(2)属于氧化还原反应。
2.步骤
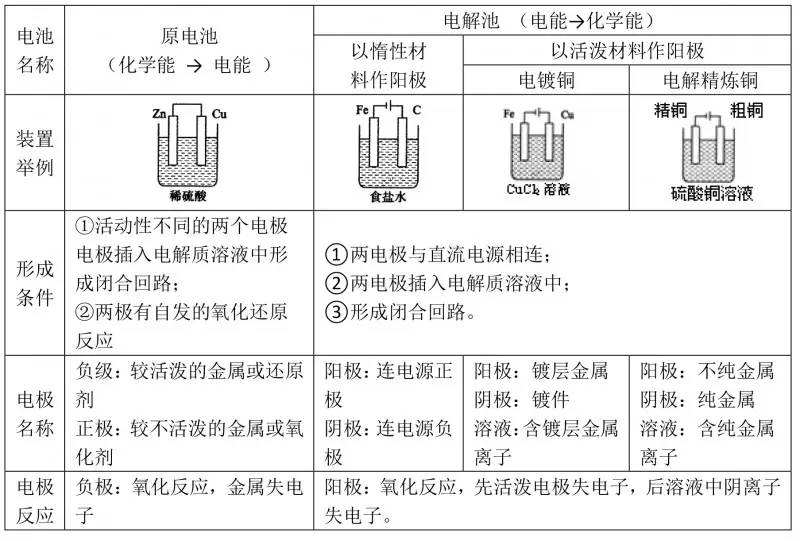
首先标明电子转移方向,根据电子转移方向判断正负极材料——失电子的为负极,得电子的为正极,其次选择相应的物质构成两个半电池——失电子金属和对应的产物构成一个半电池、得电子的离子和一较不活泼的金属或石墨构成另一半电池,最后用盐桥和导线组成闭合回路。
例如:将Fe+2FeCl3=3FeCl2设计成原电池装置
分析:Fe作负极,FeCl3作电解液,可设计成如下两种装置:
1.金属腐蚀的实质:金属原子失去电子被氧化而消耗的过程。
2.金属腐蚀分为化学腐蚀和电化学腐蚀。
3.化学腐蚀实质:金属和非电解质或其他物质相接触直接发生氧化还原反应而引起的腐蚀。其腐蚀过程没有电流产生。
4.电化学腐蚀实质:不纯金属或合金在电解质溶液中发生原电池反应。电化学腐蚀过程有电流产生。
5.腐蚀的常见类型
(1)析氢腐蚀:在酸性条件下,正极发生2H++2e-==H2↑反应。
(2)吸氧腐蚀:在极弱酸或中性条件下,正极发生2H2O+O2+4e-==4OH-反应。
6.在同一电解质溶液中,金属腐蚀的快慢可用下列关系判断:电解原理引起的腐蚀>原电池引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
原电池:负极:M-ne-==Mn+
正极:(1)酸性溶液中2H++2e-==H2↑
(2)不活泼金属盐溶液Mn++ne-==M
(3)中性、弱酸性条件下2H2O+O2+4e-==4OH-
电解(镀)池:
阳极:(1)若阳极是由活性材料(除C、Pt、Au等以外的其它金属)做成,阳极反应是阳极金属失去电子而被氧化成阳离子;
(2)若阳极是由C、Pt、Au等惰性材料做成,阳极反应则是电解液中阴离子在阳极失去电子被氧化。阴离子失去电子能力大小顺序为:I->Br->Cl->OH->含氧酸根>F-。
阴极:阴极反应一般是溶液中的阳离子得电子的还原反应,阳离子得电子能力大小顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。必须注意的是,电镀时通过控制条件,Fe2+和Zn2+得电子的能力强于H+。
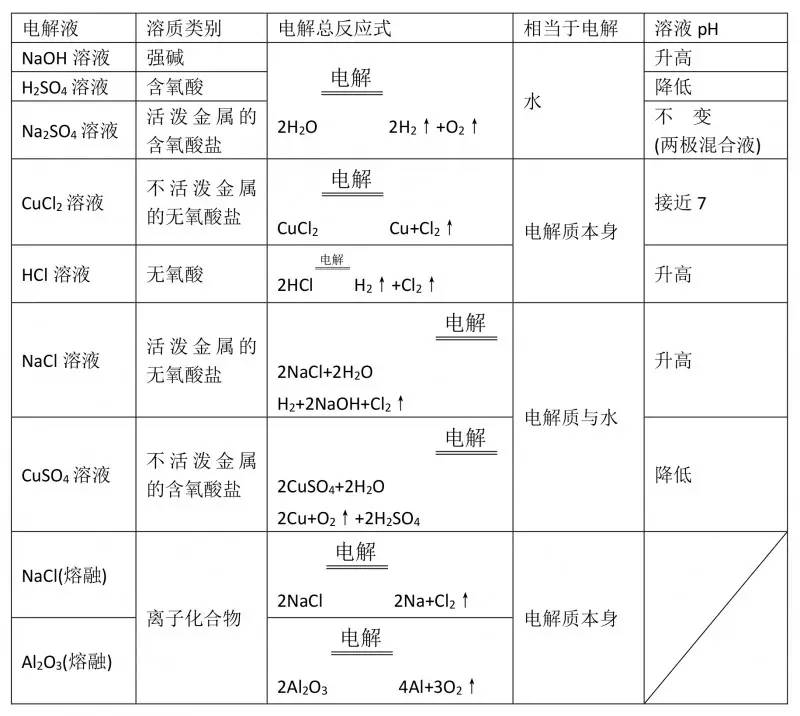

将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是( )
A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-==4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁 移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-= Cu2+
【答案】B
【解析】NaCl溶液滴到一块光亮清洁的铁板表面上,一段时间后在液滴覆盖的圆周中心区(a)被腐蚀变暗,实际上是发生了吸氧腐蚀,负极电极反应为:Fe- 2e- = =Fe2+(发生氧化反应)
正极电极反应为:O2+ 2H2O + 4e-==4OH- (发生还原反应);在液滴外沿,由于Fe2++2OH- ==Fe(OH)2 ,4Fe(OH)2+O2 +2H2O == 4Fe(OH)3形成了棕色铁锈环(b)。若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,由于Fe的金属活动性比铜强,Fe仍为负极,负极发生的电极反应为:Fe-2e-==Fe2+。又根据在原电池中,阳离子移向正极,阴离子移向负极的规律,Cl-应由b区向a区迁移。所以A、C、D选项均错误,B选项正确。
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C . 放电时OH-向正极移动
D.总反应为:2Li+2H2O==2LiOH+H2↑
【答案】C
【解析】可迅速选出C项是错误,因为原电池放电时OH-是向负极移动的。这种电池名称叫锂水电池。可推测其总反应为:2Li+2H2O==2LiOH+H2↑。再写出其电极反应如下:
负极:2Li—2e-==2Li+ ;正极:2H2O+2e-==2OH-+H2↑。结合选项分析A、B、D都是正确的。
结合右图判断,下列叙述正确的是()
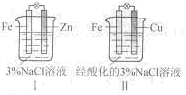
A.I和II中正极均被保护
B.I和II中负极反应均是Fe-2e-==Fe2+
C.I和II中正极反应均是O2+2H2O+4e-==4OH-
D.I和II中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
【答案】A
【解析】题给装置I、II都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护;A对;I中负极反应式为:Zn-2e-==Zn2+,B错;II中正极反应式为:2H++2e-==H2↑,C错;I中没有Fe2+,D错;选A。
小编PS:
《高考化学 | 专题6 电解质溶液 》一文中后面的习题例3的图有乱码,小编把图重新发一遍哦!
例3 图

相关文章
推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,