高考化学:可逆反应与化学平衡状态(重点)
▼ 高考化学:可逆反应与化学平衡状态(重点)
1.化学平衡研究的对象——可逆反应
(1)在相同条件下,既能向正反应方向进行,同时又能向逆反应方向进行的化学反应,称为可逆反应。在可逆反应中使用“ ”。
”。
可逆反应必须是同一条件下既能向正反应方向进行又能向逆反应方向进行的反应,对于在不同反应条件下进行的反应物、生成物正好相反的反应则不能认为是可逆反应。
(2)特点:三同一小
①三同:a.相同条件下;b.正、逆反应同时进行;c.反应物与生成物同时存在。
②一小:任一组分的转化率都小于100%。
2.化学平衡状态
一定条件下的可逆反应,当反应进行到一定程度时,正反应速率和逆反应速率相等,反应物的浓度和生成物的浓度不再改变,我们称之为“化学平衡状态”,简称化学平衡。
(1)建立过程
在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。反应过程如下:

以上过程可用如图表示:

3.化学平衡状态的特征

4.化学平衡状态的判断
(1)动态标志:v正= v逆≠0
①同种物质:同一物质的生成速率等于消耗速率。
②不同物质:必须标明是“异向”的反应速率关系。
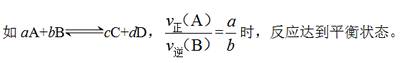
(2)静态标志:各种“量”不变
①各物质的质量、物质的量或浓度不变;
②各物质的百分含量(物质的量分数、质量分数、体积分数)不变;
③温度、压强(化学反应方程式两边气体体积不相等)或颜色(某组分有颜色)不变。
(3)综合分析
|
举例 |
mA(g)+nB(g)===pC(g) +qD(g) |
状态 |
|
混合物体系中各成分的含量 |
各物质的物质的量或各物质的物质的量分数一定 |
平衡 |
|
各物质的质量或各物质的质量分数一定 |
平衡 |
|
|
各气体的体积或体积分数一定 |
平衡 |
|
|
总压强、总体积、总物质的量一定 |
不一定平衡 |
|
|
正、逆反应速率的关系 |
在单位时间内消耗了m mol A,同时生成 m mol A,即v正=v逆 |
平衡 |
|
在单位时间内消耗了n mol B,同时生成 p mol C |
不一定平衡 |
|
|
vA∶vB∶vC∶vD=m∶n∶p∶q,v正不一定等于v逆 |
不一定平衡 |
|
|
在单位时间内生成了n mol B,同时消耗了q mol D |
不一定平衡 |
|
|
压强 |
m+n≠p+q时,总压强一定(其他条件一定) |
平衡 |
|
m+n=p+q时,总压强一定(其他条件一定) |
不一定平衡 |
|
|
混合气体的平均相对分子质量(Mr) |
Mr一定,当m+n≠p+q时 |
平衡 |
|
Mr一定,当m+n=p+q时 |
不一定平衡 |
|
|
温度 |
任何化学反应都伴随着能量的变化,在其他条件不变的情况下,体系温度一定 |
平衡 |
|
密度 |
密度一定 |
不一定平衡 |
|
颜色 |
含有有色物质的体系颜色不再变化 |
平衡 |
极端假设法确定物质的浓度范围
(1)原理:可逆反应不可能进行完全,反应体系各物质同时共存。学科*网
(2)假设反应正向或逆向进行到底,求出各物质浓度的最大值和最小值,从而确定它们的浓度范围。
判断化学平衡状态的方法——“逆向相等,变量不变”

相关文章
- 3大技巧让你高考化学选择题正确率飙升!
- 高考化学必备元素周期表6大知识点及相应29个误区判断
- 高考化学高分必备的二十种物质鉴别方法,收藏!
- 高考化学:弱电解质的电离平衡(超实用)
- 化学丨高考化学最容易丢分的30个地方
- 高考化学选择题速度慢,正确率低?这3大技巧让你的正确率飙升!
- 高考化学:化学实验基础知识归纳
- 【高考化学】化学方程式配平方法大总结!绝招+举例,招招实用!
- 高考化学:失分最严重的实验简答题专项总结!
- 高考化学50条必考基础知识点!要牢记!
- 高考化学:化学常用除杂方法及有机物除杂分析。。。
- 高考化学40个常错知识点,利用碎片时间过一遍
- 送分 | 高考化学常识题常考点,一定要背会喔~
- 解题技巧 | 高考化学元素周期律选择题突破!
- 高考化学考点突破:物质结构与性质知识汇总!
- 高考化学|| 方程式配平方法大总结!绝招+举例,招招实用!
- 高考化学:实验题,不仅要会步骤更要懂原理!
- 【高考化学】化学实验中干燥剂的选用,大题必考!
- 高考化学最容易丢分的30个地方,赶紧掌握!
- 化学|高考化学考点突破:物质结构与性质知识汇总!
推荐内容
教育新鲜事
 高二化学||化学反应速率
高二化学||化学反应速率 3大技巧让你高考化学选
3大技巧让你高考化学选 高考化学必备元素周期表
高考化学必备元素周期表 高中化学实验现象80例,
高中化学实验现象80例,